
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Температура кипения и замерзания
|
|
|
|
Все индивидуальные вещества, в том числе растворители, характеризуются строго постоянными температурами кипения-конденсации и плавления-кристаллизации (замерзания). По сравнению с ними температура кипения растворов повышается, а температура кристаллизации (замерзания) понижается, причём, понижается тем сильнее, чем концентрированнее раствор.
Разность между температурами кипения раствора и чистого растворителя называется повышением температуры кипения раствора (DTкип), а разность между температурами замерзания чистого растворителя и раствора – понижением температуры замерзания раствора (DTзам).
Изучая кипение и замерзание растворов, Рауль установил, что повышение температуры кипения и понижение температуры замерзания разбавленных растворов неэлектролитов пропорционально моляльности растворов. Эта закономерность называется вторым законом Рауля; его математическим выражением являются уравнения:
DТкип = Кэ∙Сm, DТзам = Кк∙Сm,
где Сm – моляльность раствора; Кэ – эбулиоскопическая постоянная растворителя (от лат. «ebbulire» – выкипать); Кк – криоскопическая постоянная растворителя (от греч. «криос» – холод). Эти постоянные для воды равны 0,52 и 1,86, а для спирта 1,22 и 1,99.
Понижение температуры замерзания растворов используется в технике для приготовления антифризов – жидкостей с низкой температурой замерзания, заменяющих воду в радиаторах автомобильных и авиационных моторов в зимнее время. На измерениях температур кипения и замерзания растворов основаны эбуллиоскопический и криоскопический методы определения молекулярных масс веществ.
Пример 17. Раствор, содержащий 3,2 г серы в 40 г бензола, кипит при 80,90 °С. Чистый бензол кипит при 80,10 °С. Из скольких атомов состоят молекулы серы?
Решение. 1) Вычисляем повышение температуры кипения раствора:
∆Ткип = 80,90 – 80,10 = 0,80
2) По второму закону Рауля вычисляем моляльность раствора:
 = 0,312 моль/кг С6Н6
= 0,312 моль/кг С6Н6
3) Вычисляем массу серы, приходящуюся на 1 кг растворителя:

 = 80 г
= 80 г
4) Молярную массу серы находим по пропорции:
80 г серы составляют 0,312 моль
M – 1 моль
 = 256 г/моль
= 256 г/моль
5) Молярная масса атомов серы равна 32 г/моль, следовательно, молекулы серы состоят из восьми (256: 32) атомов.
Пример 18. В радиатор автомобиля налили жидкость, состоящую из 8 л воды и 2 л метилового спирта (r = 0,8 г/мл). При какой самой низкой температуре можно после этого оставлять автомобиль на открытом воздухе, не опасаясь, что жидкость в радиаторе замёрзнет?
Решение. Задача сводится к определению (по второму закону Рауля) понижения температуры замерзания раствора по сравнению с водой.
1) Находим массу и количество метилового спирта СН3ОН, молярная масса которого 32 г/моль:
m = r·V = 0,8 · 2000 = 1600 г; 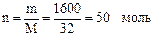
2) Исходя из того, что масса 8 л воды равна 8 кг, вычисляем моляльность раствора:
 = 6,25 моль СН3ОН/кг Н2О
= 6,25 моль СН3ОН/кг Н2О
3) По второму закону Рауля находим понижение температуры замерзания смеси по сравнению с температурой замерзания чистой воды:
∆Тзам = Кк(Н2О)·Сm = 1,86·6,25 = 11,625 град
Таким образом, самая низкая температура, при которой жидкость не замерзает, равна –11,6 °С.
ЛЕКЦИЯ 10
На этой лекции заканчивается рассмотрение материала по растворам. Нумерация элементов содержания, рисунков и примеров является продолжением предыдущей лекции.
Содержание лекции.
8. Растворы электролитов
8.1. Теория электролитической диссоциации
8.2. Степень и константа диссоциации
8.3. Ионное произведение воды
8.4. Водородный и гидроксидный показатели
9. Ионообменные реакции
9.1. Типы ионообменных реакций
9.2. Уравнения ионообменных реакций
10. Гидролиз солей
10.1. Типы гидролиза
10.2. Константа и степень гидролиза
10.3. Необратимый гидролиз
10.4. Усиление и ослабление гидролиз
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 990; Нарушение авторских прав?; Мы поможем в написании вашей работы!