
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Водородный и гидроксидный показатели
|
|
|
|
Концентрацию ионов H+ в растворах принято выражать водородным показателем. Водородный показатель – это безразмерное число, которое характеризует концентрацию катионов водорода в растворах. Обозначение водородного показателя – рН (читается «пэ-аш»). Водородный показатель связан с молярной концентрацией катионов водорода соотношением
рН = –lg[H+], или рН = –lgC(Н+)
Пользоваться водородным показателем вместо концентрации катионов водорода очень удобно, так как он равен небольшому безразмерному числу в интервале от 0 до14.
Величина рН характеризует среду раствора, которая может быть кислотной, щелочной или нейтральной.
Если рН < 7, то концентрация катионов водорода в растворе более чем 10–7 моль/л, т.е. больше, чем в чистой воде; такой раствор имеет кислотную (часто говорят: кислую) среду. Если рН > 7, то концентрация катионов водорода в растворе менее чем 10–7 моль/л, т.е. меньше, чем в чистой воде; такой раствор имеет щелочную среду. При рН = 7 среда нейтральная.
Кроме водородного показателя, используется гидроксидный показатель рОН (часто говорят: гидроксильный показатель), который связан с концентрацией ОН–-ионов в растворе соотношением:
pОН = –lg[OH–], или рОН = –lgC(ОН–)
Cумма водородного и гидроксидного показателей равна отрицательной величине десятичного логарифма ионного произведения воды, то есть числу 14:
рН + рОН = 14
Водородный показатель свежеприготовленной дистиллированной воды равен 7,00, но при стоянии она насыщается углекислым газом из воздуха, и в результате реакции
СО2 + Н2О D Н2СО3 D Н+ + НСО3–
значение рН постепенно снижается до 5,5. Водородный показатель морской воды около 8,0. Сок большинства фруктов и ягод имеет кислую среду с рН = 2,6–4,4. Физиологические жидкости организма имеют различное значение рН: плазма крови – 7,36, слёзы – 7,7, пот – 7,4, слюна – 6,51, моча – 5,8, желудочный сок – 1,65.
Пример 20. Вычислите водородный показатель растворов соляной кислоты (С = 0,005 М) и гидроксида калия (С = 4,2·10–3 М).
Решение. Оба данных раствора – это растворы сильных электролитов, которые диссоциируют необратимо:
HCl = H+ + Cl–; KOH = K+ + OН–
Поскольку из одной молекулы HCl и из одной формульной единицы КОН образуется по одному иону H+ или ОН–, то их концентрации в растворах равны концентрациям самих исходных веществ.
1) Вычисляем рН раствора соляной кислоты:
рН = –lg[H+] = –lg0,005 = 2,30
2) Вычисляем рОН раствора гидроксида калия:
рОН = –lg[ОH–] = –lg4,2∙10–3 = 2,38
3) Вычисляем рН раствора гидроксида калия:
рН = 14 – рОН = 14,00 – 2,38 = 11,62
Пример 21. Вычислите рН раствора циановодородной кислоты (константа диссоциации К = 6,2·10–10) с молярной концентрацией 0,17 М.
Решение. Циановодородная кислота, как слабый электролит, диссоциирует обратимо:
HCN D Н+ + СN–,
поэтому задачу решаем в такой последовательности: сначала вычисляем степень диссоциации, затем концентрацию H+-ионов в растворе и после этого рН.
1) Степень электролитической диссоциации вычисляем по закону разбавления Оствальда:
a =  =
= 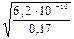 =
= 
2) Определяем концентрацию катионов водорода:
[H+] = α∙С(HCN) = 6,0·10–5·0,17 = 1,0·10–5
3) Вычисляем водородный показатель: рН = –lg[H+] = –lg1,0∙10–5 = 5
Для экспериментального определения рН используются индикаторы, специальные приборы (рН-метры) и метод титрования растворов. В качестве индикаторов используются органические вещества, окраска которых меняется в зависимости от концентрации ионов водорода. Использование индикаторов и метод титрования вы изучаются на лабораторном занятии.
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 16066; Нарушение авторских прав?; Мы поможем в написании вашей работы!