
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Типы гидролиза
|
|
|
|
Гидролиз солей
Гидролизом («гидро» – вода, «лиз» – разложение) называются реакции веществ водой. Гидролиз возможен для различных неорганических и органических соединений, но в неорганической химии он наиболее характерен для солей.
Гидролизом солей являются реакции, обратные реакциям нейтрализации слабых кислот и оснований. При взаимодействии сильных кислот со щелочами происходит полная нейтрализация этих веществ и среда становится нейтральной. Но при взаимодействии слабых электролитов полная нейтрализация невозможна. Например, взаимодействие циановодородной кислоты с гидроксидом аммония обратимо; обратная реакция цианида аммония с водой как раз и является реакцией гидролиза этой соли:
NH4CN + H2O D NH4OH + HCN
Для солей, образованных сильными основаниями (щелочами) и сильными кислотами (NaCl, CaCl2, KNO3 и т.д.), реакции гидролиза не характерны. В растворах таких солей равновесие диссоциации воды практически не нарушается и среда растворов – нейтральная (pH = 7).
Остальные соли по типу гидролиза подразделяются на три группы.
1. Соли, образованные сильными основаниями (щелочами) и слабыми кислотами: Na2CO3, KCN, Na2S, K2SiO3 и т.д. Гидролиз этих солей идёт по аниону с образованием слабых кислот, и среда раствора становится щелочной (pH > 7), например:
KCN + H2O D HCN + KOH; CN– + H2O D HCN + OH–
2. Соли, образованные слабыми основаниями и сильными кислотами: NH4Cl, ZnCl2, FeSO4, Al(NO3)3 и т.д. Гидролиз таких солей идёт по катиону с образованием слабого основания, и среда раствора становится кислотной (pH < 7), например:
 D
D 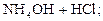
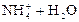 D
D 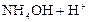
3. Соли, образованные слабыми основаниями и слабыми кислотами: NH4CN, Al(CH3COO)3, Cr2S3 и т.д. Такие соли гидролизуются по катиону и по аниону с образованием слабого основания и слабой кислоты, например:
NH4CN + H2O D NH4OH + HCN;  D
D 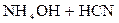
Среда растворов этих солей зависит от продуктов реакции: если основание имеет бóльшее значение константы диссоциации, то среда будет щелочной, а если кислота – то кислотной.
У солей, заряды ионов которых больше единицы, гидролиз протекает ступенчато. При этом на первой ступени образуются кислые (при гидролизе по аниону) или основные (при гидролизе по катиону) соли, которые могут подвергаться дальнейшему взаимодействию с водой. Но последующие ступени гидролиза при обычных условиях выражены настолько слабо, что их можно не принимать во внимание.
Пример 23. Опишите ступенчатый гидролиз карбоната натрия, ортофосфата калия, нитрата цинка и хлорида алюминия.
Решение. 1) Гидролиз карбоната натрия теоретически может протекать в две ступени:
– первая:  D
D 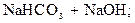
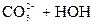 D
D 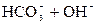
– вторая: 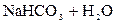 D
D 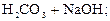
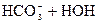 D
D 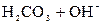
Но вторая ступень гидролиза при обычных условиях практически не идёт и её можно не учитывать. Отсутствие второй ступени гидролиза можно объяснить тем, что накопление в растворе OH–-ионов при гидролизе по первой ступени препятствует их образованию по второй.
2) При гидролизе ортофосфата калия возможны три ступени:
– первая: 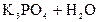 D
D 
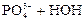 D
D 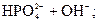
– вторая: 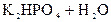 D
D 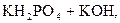
 D
D 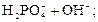
– третья: 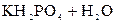 D
D 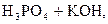
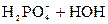 D
D 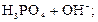
но практически фиксируются первая ступень и слабые признаки второй, а третья ступень при обычных условиях не наблюдается.
3) Гидролиз нитрата цинка идёт в две ступени:
– первая: 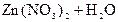 D
D 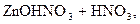
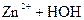 D
D 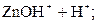
– вторая: 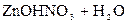 D
D 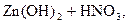
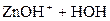 D
D 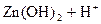
Но вторая ступень гидролиза практически не идёт. Её отсутствие можно объяснить тем, что накопление в растворе H+-ионов при гидролизе по первой ступени препятствует их образованию по второй.
4) При гидролизе хлорида алюминия возможны три ступени:
– первая: 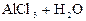 D
D 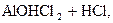
 D
D 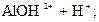
– вторая: 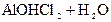 D
D 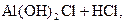
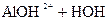 D
D 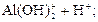
– третья: 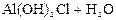 D
D 
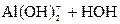 D
D 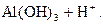
Реально при обычных условиях почти нацело проходит гидролиз по первой ступени и частично по второй, а по третьей ступени гидролиз практически не идёт.
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 7013; Нарушение авторских прав?; Мы поможем в написании вашей работы!