
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Константа и степень гидролиза
|
|
|
|
Количественной характеристикой обратимого гидролиза солей являются константа гидролиза и степень гидролиза. Константа гидролиза – это константа равновесия обратимой реакции гидролиза; она обозначается Кг (г – «гидролиз») или Kh (h – «hidrolys»). Степень гидролиза αг (или h) представляет собой отношение числа молекул, подвергшихся гидролизу, к общему числу молекул. Константа и степень гидролиза связаны между собой в соответствии с законом разбавления Оствальда.
Если соль гидролизуется только по катиону или только по аниону, то его косвенным количественным показателем является также водородный показатель: чем полнее идёт гидролиз, тем в большей степени pH отличается от числа 7 – водородного показателя нейтральной среды.
Пример 24. Вычислите константу гидролиза хлорида аммония, степень гидролиза в 0,1 М растворе и pH этого раствора. По результатам вычислений сделайте вывод.
Решение. 1) Записываем уравнение гидролиза в молекулярном и ионном виде:
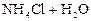 D
D 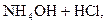
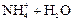 D
D 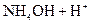
и выражение константы гидролиза:
Кг = 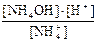
2) Умножая числитель и знаменатель правой части выражения на концентрацию гидроксид-ионов, получаем формулу для расчёта константы гидролиза; вычисляем её по справочным данным:
Кг = 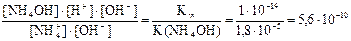
3) По закону разбавления Оствальда вычисляем степень гидролиза:
αг 
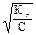 =
= 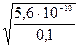 =
= 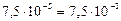 %
%
4) Рассчитываем концентрацию ионов водорода:
[H+] = αг∙С = 7,5∙10–5 0,1 = 7,5∙10–6
5) Вычисляем водородный показатель раствора:
pH = –lg[H+] = –lg(7,5∙10–6) = 5,1
Из полученных результатов следует, что гидролиз хлорида аммония протекает в незначительной степени, но, тем не менее, среда раствора кислая.
Пример 25. Вычислите константу гидролиза цианида калия, степень гидролиза в 0,1 М растворе и рН этого раствора. По результатам вычислений сделайте вывод.
Решение. Последовательность решения такая же, как и в предыдущем примере, только во втором действии правую часть выражения для константы гидролиза умножаем и делим на концентрацию катионов водорода.
1) 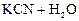 D HCN + KOH;
D HCN + KOH; 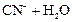 D
D 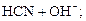 Кг =
Кг = 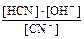
2) Кг = 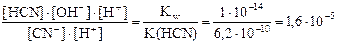
3) αг 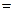
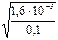
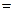
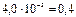 %
%
4) [ОН–] = αг∙С = 4,0∙10–3 0,1 = 4,0∙10–4
5) pОH = –lg[ОH–] = –lg(4,0∙10–4) = 3,4
6) pH = 14 – pOH = 14 – 3,4 = 11,6
Из полученных результатов следует, что гидролиз цианида калия протекает в незначительной степени, но полнее, чем хлорида аммония, поскольку HCN является менее сильным электролитом, чем NH4OH; среда раствора щелочная.
Пример 26. Вычислите константу гидролиза нитрита аммония степень гидролиза в децимолярном растворе. Сделайте вывод, определите среду раствора.
Решение. 1) Записываем уравнение и выражение константы гидролиза:
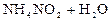 D
D 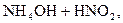
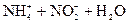 D
D 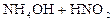
Кг = 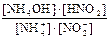
2) Умножаем числитель и знаменатель правой части выражения константы гидролиза на концентрацию катионов Н+ и анионов ОН-, получаем формулу для расчёта константы гидролиза по справочным данным:
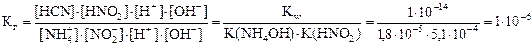
3) Вычисляем степень гидролиза:
αг 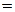
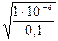
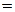
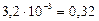 %
%
Из полученных результатов следует, что гидролиз протекает обратимо; среда раствора кислая, так как из двух образующихся слабых электролитов (NH4OH и HNO2) азотистая кислота имеет большее значение константы диссоциации.
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 5370; Нарушение авторских прав?; Мы поможем в написании вашей работы!