
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Уравнения ионообменных реакций
|
|
|
|
Типы ионообменных реакций
Ионообменные реакции
В растворах электролитов реакции протекают между ионами. Если такие реакции сопровождаются изменением степени окисления элементов, то они называются окислительно-восстановительными, а если степени окисления не изменяются, то ионообменными или, для краткости, ионными. К таким реакциям относятся взаимодействия кислот с основаниями (основно-кислотные реакции), кислот и щёлочей с солями, солей с солями, реакции гидролиза и комлексообразования.
Ионообменные реакции идут при обычной температуре с большой скоростью практически мгновенно. Это обусловлено очень низкой энергией активации, т.к. взаимодействие противоположных ионов или ионов с нейтральными молекулами требует небольшой избыточной энергии (энергии активации) только на разрушение непрочных гидратных оболочек.
Практически необратимо идут ионообменные реакции, в которых образуются слабые электролиты, осадки малорастворимых и практически нерастворимых веществ, газы. Например:
KOH + HCl = KOH + H2O – слабый электролит
BaCl2 + Na2SO4 = 2NaCl + BaSO4¯ – нерастворимое вещество
K2S + H2SO4 = K2SO4 + H2S – газообразное вещество
Кроме таких, довольно простых ионообменных реакций, часто встречаются более сложные реакции:
· образование слабого электролита и газообразного соединения одновременно:
Na2CO3 + 2HC1 = 2NaCl + H2O + СО2
· образование нерастворимого соединения и слабого электролита одновременно:
Pb(CH3COO)2 + H2SO4 = PbSO4¯ + CH3COOH
· разложение нерастворимого вещества с образованием газа:
CaCO3 + 2HCl = CaCl2 + CO2
· взаимодействие амфотерных оснований с кислотами и со щелочами:
Сr(OH)3 + ЗНСl = СгС13+ ЗН2О; Cr(OH)3 + 3NaOH = Na3[Cr(OH)6]
· получение нормальных солей из кислых и основных:
KHSO4 + KOH = K2SO4 + H2O; [СuОН]2Cl + HCl = CuCl2 + H2O
К ионообменным относятся также реакции гидролиза солей, которые рассматриваются во второй половине этой лекции.
Уравнения ионообменных реакций, кроме обычного вида, записываются в ионном виде, в котором из него исключаются ионы, которые не связываются в молекулы слабых электролитов, нерастворимых веществ, газов или комплексных соединений. Ионные уравнения ценны тем, что точнее отображают сущность реакций. Обычно одно такое уравнение соответствует нескольким молекулярным.
Рекомендуется следующая последовательность составления ионных уравнений:
1. Записывается уравнение реакции в молекулярном виде.
2. Повторяется запись уравнения, но сильные электролиты представляются в виде тех ионов, на которые они диссоциируют с учётом их числа в формуле и коэффициента перед формулой вещества.
3. Из уравнения исключаются (сокращаются) «неработающие» ионы, после чего записывается ионное уравнение в окончательном, кратком виде.
При составлении ионных уравнений необходимо отличать сильные электролиты от слабых и знать, какие вещества при условиях протекания реакций являются газами. Необходимо также иметь «под рукой» таблицу растворимости веществ. При наличии опыта краткое ионное уравнение записывается сразу же после молекулярного.
Пример 22. Напишите молекулярные и ионные уравнения следующих реакций: 1) нитрата свинца (II) с сульфидом калия; 2) серной кислоты с гипохлоритом натрия; 3) гидросульфида натрия с соляной кислотой 4) гидроксида хрома (III) с азотной кислотой. 5) гидроксида хрома (III) с гидроксидом калия.
Решение. Для первой реакции показываем всю последовательность составления ионного уравнения:
Pb(NO3)2 + K2S = 2KNO3 + PbS¯
Pb2+ + 2NO 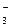 + 2K+ + S2– = 2K+ + 2NO
+ 2K+ + S2– = 2K+ + 2NO 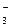 + PbS¯
+ PbS¯
Pb2+ + S2– = PbS¯
Для остальных реакций второй этап выполняется «в уме» и краткое уравнение реакции записываем сразу же после молекулярного:
H2SO4 + 2NaClO = 2HClO + Na2SO4; H+ + ClO– = HClO
NaHS + HCl = H2S + NaCl; HS– + H+ = H2S
Cr(OH)3 + 3HNO3 = Cr(NO3)3 + 3H2O; Cr(OH)3 + 3H+ = Cr3+ + 3H2O
Cr(OH)3 + 3KOH = K3[Cr(OH)6]; Cr(OH)3 + 3OH– = [Cr(OH)6]3–
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 3008; Нарушение авторских прав?; Мы поможем в написании вашей работы!