
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теория электролитической диссоциации
|
|
|
|
Растворы электролитов
Электролитами называются вещества, которые в растворах проводят электрический ток. К электролитам относятся кислоты, основания и все соли. При растворении в воде они распадаются на ионы, движение которых обеспечивает электропроводность растворов. Распад электролитов на ионы при растворении их в воде называется электролитической диссоциацией.
Основные положения теории электролитической диссоциации были разработаны С. Аррениусом (1887) и сводятся к следующему.
1. Электролиты при растворении в воде диссоциируют (распадаются) на ионы – частицы с положительным (катионы) и отрицательным (анионы) зарядом. Ионы могут быть простыми (Na+, Mg2+, Al3+ и т.д.), сложными (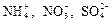 и т.д.) или комплексными [Zn(NH3)4]2+, [Fe(CN)6]3- и т.д. Название «ион» в переводе с греческого означает «странствующий»: в растворе ионы беспорядочно передвигаются («странствуют») в различных направлениях.
и т.д.) или комплексными [Zn(NH3)4]2+, [Fe(CN)6]3- и т.д. Название «ион» в переводе с греческого означает «странствующий»: в растворе ионы беспорядочно передвигаются («странствуют») в различных направлениях.
2. Под действием электрического тока движение ионов становится направленным: катионы движутся к катоду, анионы – к аноду.
3. Диссоциация – обратимый процесс, поэтому в схемах диссоциации вместо знака равенства ставится знак обратимости. Схема диссоциации электролита, состоящего из катионов (К) и анионов (А), записывается так:
КА D К+ + А–
Примечание. Позднее было установлено, что многие электролиты (они называются сильными электролитами) диссоциируют необратимо. Сильным электролитам посвящён п. 6 этой главы.
Теория Аррениуса не объясняет механизма электролитической диссоциации, так как её автор находился на позициях физической теории и не связывал распад на ионы электролитов с их взаимодействием с растворителем. Причину и механизм электролитической диссоциации объяснили российские химики И.А. Каблуков и В.А. Кистяковский (1890–1891), которые опирались на химическую теорию растворов Д.И. Менделеева.
Вещества с ионной химической связью диссоциируют необратимо. При их растворении полярные молекулы воды, являющиеся диполями, притягиваются к поверхностным ионам вещества, ориентируясь по отношению к ним противоположно заряженными полюсами. Это ион-дипольное взаимодействие приводит к ослаблению притяжения между ионами в кристаллах.В результате происходит разрыв химических связей между ионами, и ионы переходят в раствор в гидратированном состоянии (рис. 3).
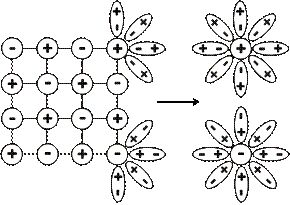
Рис 3. Схема, иллюстрирующая механизм электролитической диссоциации ионных соединений
Примечание. Ослабление химической связи между ионами определяется диэлектрической проницаемостью растворителя. Диэлектрическая проницаемость (e) показывает, во сколько раз взаимодействие между зарядами в данной среде меньше, чем в вакууме. Для воды значение диэлектрической проницаемости очень велико (e = 81), поэтому ослабление связи происходит настолько, что для распада на отдельные ионы достаточно энергии теплового движения молекул.
Доказано, что в водных растворах электролитов существуют только гидратированные ионы, свободных ионов нет. Совокупность молекул воды, окружающих ион, называется гидратной оболочкой иона. Наличие гидратных оболочек у ионов затрудняет их обратное соединение – ассоциацию. Схема электролитической диссоциации вещества в полном виде, которая отражает гидратацию ионов, записывается так:
КА + (m + n)H2O D K+·mH2O + A–·nH2O
Количество воды в гидратных оболочках ионов – неопределенное. Оно зависит от природы иона (состава, строения, размера, заряда), а также от концентрации и температуры раствора. Поэтому в схеме диссоциации содержатся неопределённые коэффициенты m и n – коэффициенты катионной и анионной гидратации. В химической практике схемы электролитической диссоциации записывают в упрщенном виде: участие воды в этом процессе не показывают.
Пример 19. Напишите схемы диссоциации: 1) кислот HNO3 и H2SO4, 2) щелочей KOH и Ba(OH)2, 3) средних солей K2SO4 и CaCl2, 4) кислой соли NaHCO3 и основной соли ZnOHCl.
Решение. 1) Азотная кислота является одноосновной кислотой и относится к сильным электролитам, поэтому она диссоциируют в одну ступень необратимо:
HNO3 = H+ + 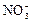
Серная кислота тоже является сильным электролитам, но, в отличие от азотной, она двухосновная, поэтому её диссоциация идёт в две ступени, причём первая ступень необратима, а вторая – обратима:
H2SO4 = H+ + 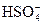 ;
; 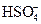 D H+ +
D H+ + 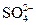
2) Аналогично диссоциируют щёлочи:
KOH = K+ + OH–;
Ba(OH)2 = BaOH+ + OH–; BaOH+ D Ba2+ + OH–
3) Нормальные соли – сильные электролиты – диссоциируют в одну ступень независимо от состава, поэтому
K2SO4 = 2K+ + 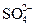 ; CaCl2 = Ca2+ + 2Cl–
; CaCl2 = Ca2+ + 2Cl–
4) Кислые и основные соли диссоциируют ступенчато: необратимо на первой ступени и обратимо на последующих:
NaHCO3 = Na+ + 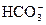 ;
; 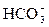 D H+ +
D H+ + 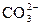
ZnOHCl = ZnOH+ + Cl–; ZnOH+ D Zn2+ + OH–
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 984; Нарушение авторских прав?; Мы поможем в написании вашей работы!