
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Степень и константа диссоциации
|
|
|
|
Для количественной характеристики обратимого процесса электролитической диссоциации используются степень диссоциации и константа диссоциации.
Степень диссоциации (a) показывает, какая доля от общего количества электролита распадается на ионы. Её выражают в долях от единицы или в процентах. Численное значение a варьируется от нуля (неэлектролиты) до 1 (или 100 %) в случае полной диссоциации электролита. Существует классификация электролитов по величине степени электролитической диссоциации, которую ввёл Аррениус.
Электролиты, для которых в децимолярном растворе при 25 ºС степень диссоциации a > 0,03 (> 3 %), называются сильными. К ним относятся почти все растворимые соли, все щелочи и ряд кислот: HCl, HBr, HI, HNO3, H2SO4, HClO3, HClO4 и некоторые другие.
Электролиты, для которых в тех же условиях a < 0,03 (< 3 %), называются слабыми. Это гидроксид аммония NH4OH и кислоты H2S, H2CO3, H2SiO3, HCN, HClO, HBrO, HIO, CH3COOН.
Иногда выделяют электролиты средней силы со степенью диссоциации от 0,03 до 0,3 (3–30 %). Это кислоты HNO2, H2SO3, HF, H3PO4, HCOOH, H2C2O4, HClO2.
Эта классификация является условной по следующим причинам.
1. Степень диссоциации зависит от природы растворителя. Например, соли (сильные электролиты в водных растворах) в органических растворителях бывают слабыми электролитами и даже неэлектролитами.
2. Степень диссоциации слабого электролита зависит от концентрации (закон разбавления Оствальда). Например, степень диссоциации азотистой кислоты равна 2,3 % (1 М), 7,1 % (0,1 М), 22,6 % (0,01 М), 71,4 % (10–3 М) и т.д. вплоть до 100 %. Иными словами, слабые электролиты в очень разбавленных растворах становятся сильными.
Другой показатель – константа диссоциации – не зависит от концентрации раствора.
К обратимой диссоциации электролитов применим закон действующих масс для химического равновесия. Константа равновесия (К) в этом случае называется константой диссоциации. Она равна произведению равновесных молярных концентраций ионов, образующихся при диссоциации электролита, делённому на равновесную молярную концентрацию недиссоциированных молекул, например:
HCN D H+ + CN–; K(HCN) = 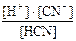
Величина константы диссоциации (справочная величина) зависит от природы электролита и растворителя и от температуры, но не зависит от концентрации раствора. Она характеризует способность вещества при растворении распадаться на ионы: чем больше величина К, тем легче электролит диссоциирует на ионы.
Сильные электролиты диссоциируют полностью, поэтому их константы диссоциации бесконечно велики и в справочной литературе не приводятся. Сильными электролитами являются соли, щёлочи и ряд кислот: соляная, азотная, серная (по первой ступени диссоциации).
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 1314; Нарушение авторских прав?; Мы поможем в написании вашей работы!