
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Молярная масса эквивалента
|
|
|
|
Э = М (AlCI3)/3 = 133,33/3 = 44,44 г/моль.
Молярная концентрация эквивалента раствора AlCI3 равна
С Н = 33,33/44,44×0,5 = 1,5 моль/л.
Пример 4. Моляльность раствора.
Определите моляльную концентрацию раствора Н3РО4, полученного при растворении 18 г кислоты в 282 см3 воды.
Решение. Моляльность раствора (Сm) показывает количество молей растворенного вещества, содержащихся в 1000 г растворителя.
Массу Н3РО4 в 1000 г растворителя находим из соотношения
 ,
,
х = (1000×18)/282 = 63,83 г.
Молярная масса Н3РО4 равна 97,99 г, отсюда
Сm = 63,83/97,99 = 0,65 м.
Пример 5. Титр раствора (Т)
Определите титр 0,01 н раствора NaOH.
Решение. Титр раствора показывает массу (г) растворенного вещества, содержащегося в 1 мл раствора. В 1 л 0,01 н раствора NaOH содержится 0,40 г NaOH. Титр этого раствора равен:
Т = 0,40/1000 = 0,0004 г/мл.
Пример 6. На нейтрализацию 50 см3 раствора кислоты из расходовано 25 см3 0,5 н раствора щелочи. Чему равна нормальность кислоты?
Решение. Так как вещества взаимодействуют между собой в эквивалентных количествах, то растворы равной нормальности реагируют в равных объемах. При разных нормальностях объемы раствора реагирующих веществ обратно пропорциональны их нормальностям, т.е. V 1/ V 2 = C H2/ C H1, или V 1× C H1= V 2 C H2, 50× C H1 = 25×0,5, откуда С Н2 = 25×0,5/50=0,25 н.
Пример 7. К 1 л 10%-ного раствора КОН (плотность 1,092 г/см3) прибавили 0,5 л 5%-ного раствора КОН (плотность 1,045 г/см3). Объем смеси довели до 2 л. Вычислите молярную концентрацию полученного раствора.
Решение. Масса одного литра 10 %-ного раствора КОН 1092 г. В этом растворе содержится
1092×10/100 = 109,2 г КОН.
Масса 0,5 л 5%-ного раствора 1045×0,5 = 522,5 г. В этом растворе содержится
522,5×5/100 = 25,125 г КОН.
В общем объеме полученного раствора (2 л) масса КОН составляет 109,2 + 26,125 = 135,325 г. Отсюда молярность этого раствора С М = 135,325/2×56,1 = 1,2 М, где 56,1 – молекулярный вес КОН.
Пример 8. Какой объем 96%-ной кислоты, плотность которой 1,84 г/см3, потребуется для приготовления 3 л 0,4 н. раствора?
Решение. Эквивалент Н2SO4 = M/2 = 98,08/2 = 49,04. Для приготовления 3 л 0,4 н. раствора требуется 49,04×0,4×3 = 58,848 г Н2SO4. Масса 1 см3 96%-ной кислоты 1,84 г. В этом растворе содержится
1,84×96/100 = 1,766 г H2SO4
Следовательно, для приготовления 3 л 0,4 н. раствора надо взять 58,848: 1,7660 = 33,32 см3 этой кислоты.
121. Вычислите молярную и нормальную концентрации 20%-ного раствора хлорида кальция, плотность которого 1,178 г/см3.
Ответ: 2,1 М; 4,2 н.
122. Чему равна нормальность 30%-ного раствора NaOH, плотность которого 1,328 г/см3?. К 1 л этого раствора прибавили 5 л воды. Вычислите процентную концентрацию полученного раствора.
Ответ: 9,96 н.; 6,3%.
123. К 3 литрам 10%-ного раствора НNO3 , плотность которого 1,054 г/см3, прибавили 5 л 2%-ного раствора той же кислоты с плотностью 1,009 г/см3. Вычислите массовую долю НNO3 и молярную концентрацию полученного раствора, если считать, что его объем равен 8 л.
Ответ: 5,0 %; 0,82 М.
124. Вычислите нормальную и моляльную концентрации 20,8%-ного раствора НNO3, плотность которого 1,12 г/см3. Сколько граммов кислоты содержится в 4 л этого раствора?
Ответ: 3,70 н.; 4,17м, 931,8 г.
125. Вычислите молярную, нормальную и моляльную концентрации 16%-ного раствора хлорида алюминия, плотность которого 1,149 г/см3.
Ответ: 1,38 М; 4,14 н.; 1,43 м.
126. Сколько и какого вещества останется в избытке, если к 75 см3 0,3 н. раствора Н2SO4 прибавить 125 см3 0,2 н раствора КОН?
Ответ: 0,14 г КОН.
127. Для осаждения в виде AgCI всего серебра, содержащегося в 100 см3 раствора AgNO3 , потребовалось 50 см3 0,2 н. раствора НCI. Чему равна нормальность раствора AgNO3 ? Сколько граммов AgCl выпало в осадок?
Ответ: 0,1 н.; 1,433 г.
128. Какой объем 20,01%-ного раствора HCl (плотность 1,100 г/см3) требуется для приготовления 1 л 10,17%-ного раствора (плотность 1,050 г/см3)?
Ответ: 485,38 см3.
129. Смешали 10 см3 10 %-ного раствора HNO3 (плотность 1,056 г/см3) и 100 см3 30%-ного раствора HNO3 (плотность 1,184 г/см3). Вычислите массовую долю НNO3 в полученном растворе.
Ответ: 28,38%.
130. Какой объем 50%-ного раствора КОН (плотность 1,538 г/см3) требуется для приготовления 3 л 6%-ного раствора (плотность 1,048 г/см3)?
Ответ: 245,5 г/см3.
131. Какой объем 10%-ного раствора карбоната натрия Na2CO3 (плотность 1,105 г/см3) требуется для приготовления 5 л 2%-ного раствора (плотность 1,02 г/см3)?
Ответ: 923,1 см3.
132. На нейтрализацию 31 см3 0,16 н. раствора щелочи требуется 217 см3 раствора H2SO4. Чему равны нормальность и титр раствора H2SO4?
Ответ: 0,023 н.; 1,127×10–3 г/см3.
133. Какой объем 0,3 н. раствора кислоты требуется для нейтрализации раствора, содержащего 0,32 г NaOH в 40 см3?
Ответ: 26,6 см3.
134. На нейтрализацию 1 л раствора, содержащего 1,4 г КОН, требуется 50 см3 раствора кислоты. Вычислить нормальность раствора кислоты.
Ответ: 0,53 н.
135. Сколько граммов НNO3 содержалось в растворе, если на нейтрализацию его потребовалось 35 см3 0,4 н. раствора NaOH? Чему равен титр раствора?
Ответ: 0,882 г; 0,016 г/см3.
136. Сколько граммов NaNO3 нужно растворить в 400 г воды, чтобы приготовить 20%-ный раствор?
Ответ: 100 г.
137. Смешали 300 г 20%-ного раствора и 500 г 40%-ного раствора NaCI. Чему равна массовая доля NaCl в полученном растворе?
Ответ: 32,5%.
138. Смешали 247 г 62%-ного и 145 г 18%-ного раствора серной кислоты. Какова массовая доля H2SO4 в растворе после смешения?
Ответ: 45,72%.
139. Из 700 г 60%-ной серной кислоты выпариванием удалили 200 г воды. Чему равна массовая доля H2SO4 в оставшемся растворе?
Ответ: 84%.
140. Из 10 кг 20%-ного раствора при охлаждении выделялось 400 г соли. Чему равна массовая доля соли в охлажденном растворе?
Ответ: 16,7%.
Свойства растворов
Пример 1. Вычислить температуры кристаллизации и кипения 2%-ного водного раствора глюкозы С6Н12О6.
Решение. По закону Рауля понижение температуры кристаллизации и повышение температуры кипения раствора (∆ t) по сравнению с температурами кристаллизации и кипения растворителя выражается уравнением
∆ t = 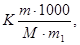 (1)
(1)
где К – криоскопическая или эбуллиоскопическая константы. Для воды они соответственно равны 1,86 и 0,52 °С; m и М – соответственно масса растворенного вещества и его молекулярный вес; m 1 – масса растворителя.
Понижение температуры кристаллизации 2%-ного раствора
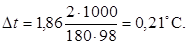
Вода кристаллизуется при 0°С, следовательно, температура кристаллизации раствора 0 – 0,21= –0,21°С.
По формул2 (1) повышение температуры кипения 2%-ного раствора С6Н12О6
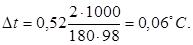
Вода кипит при 100°С, следовательно, температура кипения этого раствора 100 + 0,06 = 100,06 °С.
Пример 2. Раствор, содержащий 1,22 г бензойной кислоты С6Н5СООН в 100 г сероуглерода, кипит при 46,529 °С. Температура кипения сероуглерода 46,3°С. Вычислить эбуллиоскопическую константу сероуглерода.
Решение. Повышение температуры кипения ∆ t = 46,529 – 46,3 = 0,229 °С. Грамм-молекула бензойной кислоты 122 г. Из формулы (1) находим эбуллиоскопическую константу:
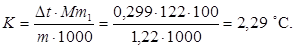
Пример 3. Раствор, содержащий 11,04 г глицерина в 800 г воды, кристаллизуется при –0,279 °С. Вычислить молекулярный вес глицерина.
Решение. Температура кристаллизации чистой воды 0°С, следовательно, понижение температуры кристаллизации ∆ t = 0 – (–0,279) = 0,279 град. Масса глицерина m (г), приходящаяся на 1000 г воды,
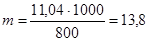 .
.
Подставляя в уравнение
 (2)
(2)
данные, вычисляем грамм-молекулярный вес глицерина:

Пример 4. Вычислить массовую долю мочевины (NН2)2CO в водном растворе, зная, что температура кристаллизации этого раствора равна –0,465 °С .
Решение. Температура кристаллизации чистой воды 0 °С, следовательно, ∆ t = 0 – (–0,465) = 0,465 °С. Зная, что грамм-молекула мочевины 60 г, находим массу m (г) растворенного вещества, приходящуюся на 1000 г воды, из формулы (2):
 .
.
Общий вес раствора, содержащего 15 г мочевины, составляет 1000 + 15 = 1015 г. Процентное содержание мочевины в данном растворе находим из соотношения
В 1015 г раствора – 15 г вещества
В 100 г раствора – х г вещества
 х = 1,48 %
х = 1,48 %
141. Раствор, содержащий 0,512 г неэлектролита в 100 г бензола, кристаллизуется при 5,296 °С. Температура кристаллизации бензола 5,5°С. Криоскопическая константа 5,1 °С. Вычислите молекулярный вес растворенного вещества.
142. Вычислите массовую долю сахара С12Н22О11 в водном растворе, зная температуру кристаллизации раствора (–0,93 °С). Криоскопическая константа воды 1,86 °С.
Ответ: 14,6%.
143. Вычислите температуру кристаллизации раствора мочевины (NH2)2CO, содержащего 5 г мочевины в 150 г воды. Криоскопическая константа воды 1,86 °С.
144. Раствор, содержащий 3,04 г камфоры С10Н16О в 100 г бензола, кипит при 80,714 °С. Температура кипения бензола 80,2°С. вычислите эбуллиоскопическую константу бензола.
145. Вычислите массовую долю глицерина С3Н5(ОН)3 в водном растворе, зная, что этот раствор кипит при 100,39 °С. Эбуллиоскопическая константа воды 0,52 °С.
Ответ:6,45%.
146. Вычислите молекулярный вес неэлектролита, зная, что раствор, содержащий 2,25 г этого вещества в 250 г воды, кристаллизуется при –0,279°С . Криоскопическая константа воды 1,86 °С.
147. Вычислите температуру кипения 5%-ного раствора нафталина С10Н8 в бензоле. Температура кипения бензола 80,2 °С. Эбуллиоскопическая константа его 2,57 °С.
Ответ:81,25 °С .
148. Раствор, содержащий 25,65 г некоторого неэлектролита в 300 г воды, кристаллизуется при –0,465°С. Вычислите молекулярный вес растворенного вещества. Криоскопическая константа воды 1,86 °С.
149. Вычислите криоскопическую константу уксусной кислоты, зная, что раствор, содержащий 3,56 г антрацена С14Н10 в 100 г уксусной кислоты, кристаллизуется при 15,718 °С . Температура кристаллизации уксусной кислоты 16,65 °С.
150. Равные весовые количества камфоры С10Н16О и нафталина С10Н8 растворены в одинаковых количествах бензола. Какой из растворов кипит при более высокой температуре?
151. Температура кристаллизации раствора, содержащего 66,3 г некоторого неэлектролита в 500 г воды, равна –0,558°С . Вычислите молекулярный вес растворенного вещество. Криоскопическая константа воды 1,86°С.
152. Сколько граммов анилина С6Н5NH2 следует растворить в 50 г этилового эфира, чтобы температура кипения раствора была выше температуры кипения этилового эфира на 0,53 °С? Эбуллиоскопическая константа этилового эфира 2,12 °С.
Ответ: 1,16 г.
153. Вычислите температуру кристаллизации 2%-ного раствора этилового спирта С2Н5ОН, зная, что криоскопическая константа воды 1,86 °С.
Ответ: –0,82°С .
154. Сколько граммов мочевины (NH2)2CO следует растворить в 75 г воды, чтобы температура кристаллизации понизилась на 0,465 °С?
Ответ: 1,12 г.
155. Вычислите массовую долю глюкозы С6Н12О6, в водном растворе, зная, что этот раствор кипит при 100,26 °С. Эбуллиоскопическая константа воды 0,52 °С.
Ответ:8,25%.
156. Сколько граммов фенола С6Н5ОН следует растворить в 125 г бензола, чтобы температура кристаллизации раствора была ниже температуры кристаллизации бензола на 1,7 °С? Криоскопическая константа бензола 5,1 °С.
Ответ:3,91 г.
157. Сколько граммов мочевины (NH2)2CO, следует растворить в 250 г воды, чтобы температура кипения повысилась на 0,26 °С? Эбуллиоскопическая константа воды 0,52 °С.
Ответ: 7,5 г.
158. При растворении 2,3 г некоторого неэлектролита в125 г воды температура кристаллизации понижается на 0,372 °С. Вычислите молекулярный вес растворенного вещества. Криоскопическая константа воды 1,86 °С.
159. Вычислите температуру кипения 15%-ного водного раствора пропилового спирта С3Н7ОН, зная, что эбуллиоскопическая константа воды 0,52 °С.
Ответ:101,52°С .
160. Вычислите массовую долю метанола СН3ОН в водном растворе, температура кристаллизации которого –2,79°С . Криоскопическая константа воды 1,86 °С.
Ответ: 4,58%.
Ионные реакции обмена
При химической реакции в растворах электролитов взаимодействуют не молекулы, а ионы. Например, уравнение реакции в молекулярной форме:
Ba(NO3)2 + H2SO4 = BaSO4↓ + 2HNO3,
уравнение в полном ионном виде, или полное ионное уравнение:
Ba2+ + 2NO3– + 2H+ + SO42– = BaSO4↓ + 2Н+ + 2NO3–,
уравнение в сокращенном ионном виде, или сокращенное ионное уравнение:
Ba2+ + SO42– = BaSO4↓.
Протекание реакции между электролитами возможно в трех случаях:
1. Если ионы, соединяясь, образуют труднорастворимое соединение.
Например:
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4,
Cu2+ + SO42– + 2Na+ + 2OH– = Cu(OH)2↓ +2Na+ + SO42–,
Cu2+ + 2OH– = Cu(OH)2↓.
2. Если при взаимодействии ионов образуется летучее вещество. Например:
Na2S + 2HCl = 2NaCl + H2S↑,
2Na+ + S2– + 2H+ + 2Cl– = 2Na+ + 2Cl– + H2S↑,
S2– + 2H+ = H2S ↑.
3. Если при взаимодействии ионов образуется малодиссоциирующий электролит. Например:
NaOH + HCl = NaCl + H2O,
Na+ + OH– + H+ + Cl– = Na+ + Cl– + H2O,
H+ + OH– = H2O.
При всех подобных реакциях взаимодействие между данными ионами происходит независимо от присутствия других, не участвующих в реакции ионов.
Соединения, выпадающие в осадок, газообразные и малодиссоциирующие, в ионных уравнениях записываются в молекулярной форме.
161. Составьте молекулярные и ионные уравнения реакций, протекающих между веществами NaHCO3 и NaOH; К2SiO3 и HCI; ВаСI2 и Na2SO4.
162. Составьте молекулярные и ионные уравнения реакций, протекающих между веществами К2S и HCI; FeSO4 и (NH4)2S; Cr(OH)3 и KOH.
163. Составьте молекулярные уравнения реакций, которые выражаются ионными уравнениями:
Zn2+ + H2S = ZnS + 2H+,
Mg2+ + CO32– = MgCO3,
H+ + OH– = H2O.
164. К каждому из веществ: Al (OH)3; H2SO4; Ba(OH)2 – прибавили раствор едкого кали. В каких случаях произошли реакции? Выразите их молекулярными и ионными уравнениями.
165. Составьте молекулярные и ионные уравнения реакций, протекающих между веществами КНСО3 и Н2SO4; Zn(OH)2 и NaOH; CaCI2 и AgNO3.
166. Составьте молекулярные и ионные уравнения реакций, протекающих между веществами CuSO4 и H2S; BaCO3 и HNO3; FeCI3 и КОН.
167. Составьте молекулярные уравнения реакций, которые выражаются ионными уравнениями:
Cu2+ + S2– = CuS,
Pb(OH)2 + 2OH– = PbO22– + 2H2O,
SiO32– + 2H+ = H2SiO3.
168. Составьте молекулярные и ионные уравнения реакций, протекающих между веществами Sn(OH)2 и HCI; BeSO4 и KOH; NH4CI и Ba(OH)2.
169. К каждому из веществ: КНСО3, СН3СООН, NiSO4, Na2S – прибавили раствор серной кислоты. В каких случаях произошли реакции? Выразите их молекулярными и ионными уравнениями.
170. Составьте молекулярные и ионные уравнения реакций, протекающих между веществами Нg(NO3)2 и NaI; Pb(NO3)2 и KI; CdSO4 и Na2S.
171. Составьте молекулярные уравнения реакций, которые выражаются ионными уравнениями:
CaCO3 + 2H+ = Ca2+ + H2O + CO2,
Al(OH)3 + OH– = AlO2– + 2H2O,
Pb2+ + 2I– = PbI2.
172. Составьте молекулярные и ионные уравнения реакций растворения дигидроксида бериллия в растворе едкого натра; дигидроксида меди в растворе азотной кислоты.
173. Составьте молекулярные и ионные уравнения реакций, протекающих между веществами Na3PO4 и CaCI2; К2СО3 и ВаСI2; Zn(OH)2 и КОН.
174. Составьте молекулярные уравнения реакций, которые выражаются ионными уравнениями:
Fe(OH)3 + ЗH+ = Fе3+ + ЗН2O,
Сd2+ + 2ОН-= Сd(ОН)2,
H+ +NO2– = НNО2.
175. Составьте молекулярные и ионные уравнения реакций, протекающих между веществами СdS и НСI; Сr(ОН)3 и NаОН; Ва(ОН)2 и СоСI2.
176. Составьте молекулярные уравнения реакций, которые выражаются ионными уравнениями:
Zn2+ + Н2S = ZnS + 2Н+,
НСО3- + Н+ = Н2O + СО2,
Ag+ + СI- = AgСI.
177. Составьте молекулярные и ионные уравнения реакций, протекающих между веществами Н2SО4 и Ва(ОН)2; FеС13 и NH4ОН; СН3СООNа и НСI.
178. Составьте молекулярные и ионные уравнений реакций, протекающих между веществами FеСI3 и КОH; NiSO4 и (NH4)2S; MgСО3 и НNO3.
179. Составьте молекулярные уравнения реакций, которые выражаются ионными уравнениями:
Bе(ОН)2 + 2OН– = ВеО22– + 2Н2O,
СН3СОО– + Н+ = СН3СООН,
Ва2+ + SO42– = ВаSO4.
180. K каждому из веществ: NаСI, NiSO4, Ве(ОН)2, КНСО3 – прибавили раствор гидроксида натрия. В каких случаях произошли реакции? Выразите их молекулярными и ионными уравнениями.
Гидролиз солей
Гидролизом солей называют реакции обмена между водой и растворенными в ней солями. В результате протекания процесса гидролиза соли в растворе появляется некоторое избыточное количество ионов H+ или OH–, сообщающие раствору кислотные или щелочные свойства. Гидролиз возможен в трех случаях:
|
|
|
|
|
Дата добавления: 2014-12-17; Просмотров: 1157; Нарушение авторских прав?; Мы поможем в написании вашей работы!