
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Актиноиды 1 страница
|
|
|
|
.
Решение. Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса при помощи электронных уравнений. Вычисляем, как изменяют свою степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях:

 восстановитель 5 P3+–2 ē = P5+ процесс окисления;
восстановитель 5 P3+–2 ē = P5+ процесс окисления;
окислитель 2 Mn7++5 ē = Mn2+ процесс восстановления.
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которое присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов является число 10. Разделив это число на 5, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 10 на 2 получаем коэффициент 5 для восстановителя и продукта его окисления. Коэффициенты перед веществами, атомы которых не меняют свою степень окисления, находят подбором. Уравнение реакции будет иметь вид
2КMnО4 + 5Н3PO3 + 3H2SO4 = 2MnSO4 + 5Н3РО4 + K2SO4 + 3H2O.
Пример 4. Составьте уравнение реакции взаимодействия цинка с концентрированной серной кислотой, учитываz максимальное восстановление последней.
Решение. Цинк как любой металл проявляет только восстановительные свойства. В концентрированной серной кислоте окислительную функцию несет сера (+6). Максимальное восстановление серы означает, что она приобретает минимальную степень окисления. Минимальная степень окисления серы как р -элемента VI А группы равна –2. Цинк как металл II В группы имеет постоянную степень окисления +2. Отражаем сказанное в электронных уравнениях:
 4 Zn0 – 2 ē = Zn2+
4 Zn0 – 2 ē = Zn2+
1 S6+ + 8 ē = S2–
Составляем уравнение реакции:
4Zn + 5Н2SO4 = 4ZnSO4 + Н2S + 4Н2O.
Перед Н2SO4 стоит коэффициент 5, а не 1, ибо четыре молекулы Н2SO4 идут на связывание четырех ионов Zn2+.
201. Исходя из степени окисления хлора в соединениях НСl, НСlO3 НСlO4, определите, какое из них является только окислителем, только восстановителем и какое может проявлять как окислительные, так и восстановительные свойства. Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме
КВr + КBrО3 + Н2SО4 ® Вr2 + К2 SO4 + H2O.
202. Реакции выражаются схемами:
Р + НIO3 + Н2O ® Н3РО4 + Нl,
Н2S + Сl2+Н2O ® Н2SO4 + НСl.
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое восстановителем; какое вещество окисляется, какое – восстанавливается.
203. Составьте электронные уравнения и укажите, какой процесс – окисление или восстановление – происходит при следующих превращениях:
Аs3– ® As5+; N3+ ® N3–; S2– ® S0.
На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме
Na2SO3 + КMnО4 + Н2O ® Nа2SO4 + МnО2 + КОН.
204. Исходя из степени окисления фосфора в соединениях РН3, Н3РO4, Н3РО3 определите, какое из них является только окислителем, только восстановителем и какое может проявлять как окислительные, так и восстановительные свойства. Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме РbS + НNО3 ® S + Рb(NО3)2 + NO2 + Н2O.
205*. КMnО4 + Nа2SO3 + КОН ® К2МnО4 + Nа2SO4, + Н2О,
P + НNО3 +Н2O ® Н3PО4 + NO.
206. Составьте электронные уравнения и укажите, какой процесс – окисление или восстановление – происходит при следующих превращениях: Мn6+® Mn2+ ® Cl5+ ® Cl– ; N3– ® N5+. На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме Сu2O+НNO3®Сu(NО3)2 +NO+Н2О.
207*. НNO3 + Са ® NН4NО3 + Са(NO3)2 + Н2О,
К2S + КMnO4 + Н2SO4 ® S + К2SO4 + МnSO4 + Н2O.
208. Исходя из степени окисления хрома, йода и серы в соединениях К2Сr2О7, КI и Н2SО3 определите, какое из них является только окислителем, только восстановителем и какое может проявлять как окислительные, так и восстановительные свойства. Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме:
NaCrО2 + РbО2 + NаОН ®Na2CrО4 + Nа2PbО2 + Н2О.
209*. Н2S + Сl2 + Н2O ® Н2SO4 + НСI,
К2Cr2О7 + Н2S + Н2SО4 ® S + Сr2 (SO4)3 + K2SO4 + H2O.
210*. KClO3 + Na2SO3 ® KCl + Na2SO4,
KMnO4 + HBr ® Br2 + KBr + MnBr2 + H2O.
211*. P + HClO3 + H2O ® H3PO4 + HCl,
H3AsO3 + KMnO4 + H2SO4 ® H3AsO4 + MnSO4 + K2SO4 + H2O.
212*. NaCrO2 + Br2 + NaOH ® 2Na2CrO4 + NaBr + H2O,
FeS + HNO3 ® Fe(NO3)2 + S + NO + H2O.
213*. HNO3 + Zn ® N2O + Zn(NO3)2 + H2O,
FeSO4 + KClO3 + H2SO4 ® Fe2(SO4)3 + KCl + H2O.
214*. K2Cr2O7 + HCl ® Cl2 + CrCl3 + KCl + H2O,
Au + HNO3 + HCl ® AuCl3 + NO + H2O.
215. Могут ли происходить окислительно-восстановительные реакции между веществами: а) NH3 и KMnO4; б) HNO2 и HI; в) НСl и H2Se? Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме
KMnO4 + KNO2 + H2SO4 ® MnSO4 + KNO3 + K2SO4 + H2O.
216*. HCl + CrO ® Cl2 + CrCl3 + H2O,
Cd + KMnO4 + H2SO4 ® CdSO4 + K2SO4 + MnSO4 + H2O.
217*. I2 + NaOH ® NaOI + NaI,
MnSO4 + PbO2 + HNO3 ® HMNO4 + Pb(NO3)2 + PbSO4 + H2O.
218*. H2SO3 + HClO3 ® H2SO4 + HCl,
FeSO4 + K2Cr2O7 + H2SO4 ® Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O.
219*. I2 + Cl2 + H2O ® HIO3 + HCl,
FeCO3 + KMnO4 + H2SO4 ® Fe2(SO4)3 + CO2 + MnSO4 + К2SO4 + H2O.
220. Могут ли происходить окислительно-восстановительные реакции между веществами: а) РН3 и НВr; б) K2Cr2O7 и H3PO3; в) HNO3 и H2S? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей посхеме AsH3 + HNO3 ® H3AsO4 + NO2 + H2O.
Электродные потенциалы и электродвижущие силы*
Если металлическую пластинку опустить в воду, то расположенные на ее поверхности катионы металла будут гидратироваться полярными молекулами воды и переходить в жидкость. При этом электроны, в избытке остающиеся в металле, заряжают его поверхностный слой отрицательно. Возникает электростатическое притяжение между перешедшими в жидкость гидратированными катионами и поверхностью металла. В результате этого в системе устанавливается подвижное равновесие:
Me + m H2O=Me(H2O) n + m + ne– ,
в растворе на металле
где n - число электронов, принимающих участие в процессе. На границе металл - жидкость возникает двойной электрический слой, характеризующийся определенным скачком потенциала — электродным потенциалом. Абсолютные значения электродных потенциалов измерить не удается. Электродные потенциалы зависят от ряда факторов (природы металла, концентрации, температуры и др.). Поэтому обычно определяют относительные электродные потенциалы в определенных условиях, называемых стандартными электродными потенциалами (Е °).
Стандартным электродным потенциалом металла называют его электродный потенциал, возникающий при погружении металла в раствор собственного иона с концентрацией или активностью, равной 1 моль, измеренный по сравнению со стандартным водородным электродом, потенциал которого при 25°С условно принимается равным нулю (Е ° = 0; D G 0 = 0).
Располагая металлы в ряд по мере возрастания их стандартных электродных потенциалов (Е°), получаем так называемый “ ряд напряжений ”. Положение того или иного металла в ряду напряжений характеризует его восстановительную способность, а также окислительные свойства его ионов в водных растворах при стандартных условиях. Чем меньше значение Е °, тем большими восстановительными способностями обладает данный металл в виде простого вещества и тем меньше окислительные способности проявляют его ионы. И наоборот. Электродные потенциалы измеряют в приборах, которые получили название гальванических элементов. Окислительно-восстановительная реакция, которая лежит в основе работы гальванического элемента, протекает в направлении, в котором ЭДС с. элемента имеет положительное значение. В этом случае D G 0 < 0, так как D G 0 = - nFE °.
Пример 1. Стандартный электродный потенциал никеля больше, чем у кобальта (табл. 4). Изменится ли это соотношение, если измерить потенциал никеля в растворе его ионов с концентрацией 0,001 моль/л, а кобальта – 0,1 моль/л?
Решение. Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:
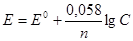 ,
,
где Е '° - стандартный электродный потенциал; п- число электронов, принимающих участие в процессе; С - концентрация (при точных вычислениях – активность) гидратированных ионов металла в растворе, моль/л. Е ° для никеля и кобальта соответственно равны -0,25 и -0,277 В. Определим электродные потенциалыэтих металлов при данных в условии концентрациях:
Е (Ni2+/Ni)= -0,25 + (0,058/2)lg10–3 = -0,337 B,
Е (Co2+/Co)= -0,277 + (0,058/2)lg10–1 = -0,306 B.
Таким образом, при изменившейся концентрации потенциал кобальта стал больше потенциала никеля.
Таблица 4
Стандартные электродные потенциалы Е ° некоторых металлов
(ряд напряжений)
| Электрод | Е °, В | Электрод | Е °, В |
| Li+/Li | -3,045 | Cd2+/Cd | -0,403 |
| Rb+/Rb | -2,925 | Co2+/Co | -0,277 |
| K+/K | -2,924 | Ni2+/Ni | -0,25 |
| Cs+/Cs | -2,923 | Sn2+/Sn | -0,136 |
| Ba2+/Ba | -2,90 | Pb2+/Pb | -0,127 |
| Ca2+/Ca | -2,87 | Fe3+/Fe | -0,037 |
| Na+/Na | -2,714 | 2H+/H2 | -0,000 |
| Mg2+/Mg | -2,37 | Sb3+/Sb | +0,20 |
| Al3+/Al | -1,70 | Bi3+/Bi | +0,215 |
| Ti2+/Ti | -1,603 | Cu2+/Cu | +0,34 |
| Zr4+/Zr | -1,58 | Cu+/Cu | +0,52 |
| Mn2+/Mn | -1,18 | Hg2+2/2Hg | +0,79 |
| V2+/V | -1,18 | Ag+/Ag | +0,80 |
| Cr2+/Cr | -0,913 | Hg2+/Hg | +0,85 |
| Zn2+/Zn | -0,763 | Pt2+/Pt | +1,19 |
| Cr3+/Cr | -0,74 | Au3+/Au | +1,50 |
| Fe2+/Fe | -0,44 | Au+/Au | +1,70 |
Пример 2. Магниевую пластинку опустили в раствор его соли. При этом электродный потенциал магния оказался равен -2,41 В. Вычислите концентрацию ионов магния в моль/л.
Решение. Подобные задачи также решаются на основании уравнения Нернста (см. пример 1);
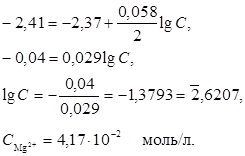
Пример 3. Составьте схему гальванического элемента, в котором электродами являются магниевая и цинковая пластинки, опущенные в растворы их ионов с активной концентрацией 1 моль/л. Какой металл является анодом, какой катодом? Напишите уравнение окислительно-восстановительной реакции, протекающей в этом гальваническом элементе, и вычислите его ЭДС.
Решение. Схема данного гальванического элемента
(-)Mg½Mg2+║Zn2+½Zn(+).
Вертикальная черта обозначает поверхность раздела между металлом и раствором, а две черточки - границу раздела двух жидких фаз - пористую перегородку (или соединительную трубку, заполненную раствором электролита). Магний имеет меньший потенциал(-2,37 В) иявляется анодом, на котором протекаетокислительный процесс:
Mg-2ē=Mg2+. (1)
Цинк, потенциал которого -0,763 В, - катод, т. е. электрод, на котором протекает восстановительный процесс:
Zn2+ + 2ē = Zn. (2)
Уравнение окислительно-восстановительной реакции, которая лежит в основе работы данного гальванического элемента, можно получить, сложив электронные уравнения анодного (1) и катодного (2) процессов:
Mg + Zn2+ = Mg2+ + Zn.
Для определения электродвижущей силы - ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода. Так как концентрация ионов в растворе равна 1моль/л, то ЭДС элемента равна разности стандартных потенциалов двух его электродов:
ЭДС = Е °(Zn2+/Zn) - Е °(Mg2+/Mg)= -0,763 - (-2,37)=1,607 B.
221. В один из сосудов с голубым раствором медного купороса поместили цинковую пластинку, а во второй – серебряную. В каком сосуде цвет раствора постепенно пропадает? Почему? Составьте электронные и молекулярное уравнения соответствующей реакции.
222. Увеличится, уменьшится или останется без изменения масса цинковой пластинки при взаимодействии ее с растворами: a) CuSO4; б) MgSO4; в) Pb(NO3)2? Почему? Составьте электронные и молекулярные уравнения соответствующих реакций.
223. При какой концентрации ионов Zn2+ (моль/л), потенциал цинкового электрода будет на 0,015 В меньше его стандартного электродного потенциала.
Ответ: 0,30 моль/л.
224. Увеличится, уменьшится или останется без изменения масса кадмиевой пластинки при взаимодействии ее с растворами: a) AgNO3; б) ZnSO4; в) NiSО4? Почему? Составьте электронные и молекулярные уравнений соответствующих реакций.
225. Марганцевый электрод в растворе его соли имеет потенциал -1,23 В. Вычислите концентрацию ионов Мn2+ в моль/л.
Ответ: 1,89×10–2 моль/л.
226. Потенциал серебряного электрода в растворе AgNO3 составил 95% от величины его стандартного электродного потенциала. Чему равна концентрация ионов Ag+ в моль/л?
Ответ: 0,20 моль/л.
227. Никелевый и кобальтовый электроды опущены соответственно в растворы Ni(NО3)2 и Co(NO3)2. В каком соотношении должна быть концентрация ионов этих металлов, чтобы потенциалы обоих электродов были одинаковыми?
Ответ: С Ni2+: C Co2+» 0,117.
228. Составьте схемы двух гальванических элементов, в одном из которых медь была бы катодом, а в другом – анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и на аноде.
229. При какой концентрации ионов Сu2+ в моль/л значение потенциала медного электрода становится равным стандартному потенциалу водородного элемента?
Ответ: 1,89×10–12 моль/л.
230. Какой гальванический элемент называется концентрационным? Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из серебряных электродов, один из которых погружен в 0,01 М, а второй, – в 0,1 М растворы AgNO3.
Ответ: 0,058 В.
231. При каком условии будет работать гальванический элемент, электроды которого сделаны из одного и того же металла? Составьте схему, напишите, электронные уравнения электродных процессов и вычислите ЭДС, гальванического элемента, в котором один никелевый электрод находится в 0,001 М растворе, а другой такой же электрод - в 0,01 М растворе сульфата никеля.
Ответ: 0,029 В.
232. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальваническою элемента, состоящего из свинцовой и магниевой пластин, опущенных в растворы своих солей с концентрацией С Рb2+ = С Мg2+ = 0.01 моль/л. Изменится ли ЭДС этого элемента, если концентрацию каждого из ионов увеличить в одинаковое число раз?
Ответ: 2,244 В.
233. Составьте схемы двух гальванических элементов, в одном из которых никель является катодом, а в другом – анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и на аноде.
234. Железная и серебряная пластины соединены внешним проводником и погружены в раствор серной кислоты. Составьте схему данного гальванического элемента, напишите электронные уравнения процессов, происходящих на аноде и на катоде.
235. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из пластин кадмия и магния, опущенных в растворы своих солей с концентрацией С Mg2+ = М Cd2+ = 1 моль/л. Изменится ли величина ЭДС, если концентрацию каждого из ионов понизить до 0,01 моль/л?
Ответ: 1,967 В.
236. Составьте схему гальванического элемента, состоящего из пластин цинка и железа, погруженных в растворы их солей. Напишите электронные уравнения процессов, протекающих на аноде и на катоде. Какой концентрации надо было бы взять ионы железа (в моль/л), чтобы ЭДС элемента стала равной нулю, если С Zn2+ = 0,001моль/л?
Ответ: 7,3×10-15 моль/л.
237. Составьте схему гальванического элемента, в основе которого лежит реакция, протекающая по уравнению:
Ni + Pb(NO3)2 = Ni(NO3)2 + Рb.
Напишите электронные уравнения анодного и катодного процессов. Вычислите ЭДС этого элемента, если С Ni2+= 0,01 моль/л, С Pb2+ = 0,0001 моль/л.
Ответ: 0.066 В.
238. Какие химические процессы протекают в электродах при зарядке и разрядке свинцового аккумулятора?
239. Какие химические процессы протекают на электродах при зарядке и разрядке кадмийникелевого аккумулятора?
240. Какие химические процессы протекают на электродах при зарядке и разрядке железоникелевого аккумулятора?
Электролиз
Электролизом называют совокупность химических процессов, которые протекают под действием электрического тока на электродах, погруженных в раствор или расплав электролита. Например, если в расплав хлорида натрия погрузить инертные электроды и пропустить постоянный электрический ток, то ионы будут двигаться к электродам: катионы Na+ - к катоду; анионы Cl– - к аноду.
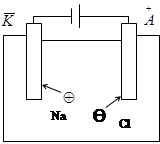 На катоде протекает процесс восстановления:
На катоде протекает процесс восстановления:
Na+ + ē = Na,
на аноде – процесс окисления:
2Cl– – 2ē = Cl2. Суммарная реакция:
 2Na+ + 2Cl– 2Na + Cl2 или
2Na+ + 2Cl– 2Na + Cl2 или
2NaCl 2Na + Cl2.
При электролизе водных растворов в процессах могут участвовать молекулы воды. Тогда на катоде может происходить восстановление ионов металла и водорода.
Рассматривая катодные процессы, протекающие при электролизе водных растворов, нужно учитывать величину потенциала процесса восстановления ионов водорода. Этот потенциал зависит от концентрации ионов водорода [H+] и парциального давления водорода PH2.
 .
.
Обычно парциальное давление водорода Р H2поддерживается равным нормальному атмосферному давлению, которое условно принимается за единицу (lg 1 = 0). Тогда
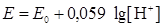 .
.
Поскольку стандартный потенциал процесса восстановления ионов водорода принимаем равным нулю, а lg[H+] = –pH, то получим
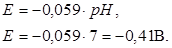
В нейтральных растворах (pH = 7) потенциал имеет значение K?
Поэтому, если катионом электролита является металл, электродный потенциал которого значительно положительнее, чем –0,41В, то из нейтрального раствора такого электролита на катоде будет выделяться металл. Такие металлы находятся в ряду напряжений вблизи водорода, начиная приблизительно с олова. Если катионом электролита является металл, имеющий потенциал значительно более отрицательный, чем –0,41В, металл восстанавливаться не будет, а произойдет выделение водорода. К таким металлам относятся металлы начала ряда напряжений, расположенные до титана. Наконец, если потенциал металла близок величине –0,41В (металлы средней части ряда напряжений – Zn, Cr, Fe, Cd, Ni), то в зависимости от концентрации раствора и условий электролиза возможно как восстановление металла, так и выделение водорода; нередко наблюдается совместное выделение металла и водорода.
Электрохимическое выделение водорода из кислых растворов, pH которых < 7, происходит вследствие разряда ионов водорода.
2H+ + 2ē = H2.
В случае же нейтральных или щелочных сред оно является результатом электрохимического восстановления воды: 2H2O + 2ē = H2 + 2OH–.
При рассмотрении анодного процесса следует иметь в виду, что материал анода в ходе электролиза может окисляться. В связи с этим различают электролиз с инертным анодом и электролиз с активным анодом. Инертным называется анод, материал которого не претерпевает окисления в ходе электролиза (чаще всего графит, уголь, платина, свинец).
На инертном аноде при электролизе происходит окисление воды с выделением кислорода. В щелочной среде уравнение имеет вид
4OH– – 4ē = O2 + 2H2O,
а в кислой и нейтральной:
2H2O – 4ē = O2 + 4H+.
Кислородосодержащие анионы (SO24–, NO–2, SO32–) или не способны окисляться, или их окисление происходит при очень высоких потенциалах. Например, стандартный потенциал окисления иона SO24– до S2O82– равен 2,01 В, что значительно превышает потенциал окисления воды (1,23 В). При электролизе водных растворов бескислородных кислот и их солей у анода разряжаются анионы.
В случае активного анода число конкурирующих окислительных процессов возрастает до трех: электрохимическое окисление воды, разряд анионов и электрохимическое окисление металла анода (анодное растворение металла). Будет идти тот процесс, потенциал которого меньше. Например, при электролизе NiSO4 с никелевым анодом происходит процесс окисления металла: Ni – 2ē → Ni2+.
Пример 1. Сколько граммов меди выделится на катоде при электролизе раствора CuSO4 в течение 1 ч при силе тока 4 А?
Решение. Согласно законам Фарадея
т = Эit /96500, (1)
где m - масса вещества, окисленного или восстановленного на электроде; Э – грамм-эквивалент вещества; i- сила тока; t- продолжительность электролиза, с.
Грамм-эквивалент меди в CuSO4 равен 63,54/2 = 31,77 г. Подставив в формулу (1) значения Э = 31,77, i = 4 A, t = 60×60 = 3600 ч, получим
m = (31,77×4×3600)/96500 = 4,74 г.
Пример 2. Вычислить эквивалент металла, зная, что при электролизе раствора хлорида этого металла затрачено 3880 Кл электричества и на катоде выделяется 11,742 г металла.
Решение. Из формулы (1)
Э = 11,742×96500/3880 = 29,35,
где m= 11,742 г; it = Q= 3880 Кл.
Пример 3. Чему равна сила тока при электролизе раствора в течение 1 ч 40 мин 25 с, если на катоде выделилось 1,4 л водорода, измеренного при нормальных условиях?
Решение. Из формулы (1)
i = m ×96500/ Эt.
Так как количество водорода дано в объемных единицах, то отношение т/Э заменяем отношением V H2/ V г-экв Н2, где V H2- объем водорода в литрах; V г-экв Н2- объем грамм-эквивалента водорода в литрах. Тогда
|
|
|
|
|
Дата добавления: 2014-12-17; Просмотров: 817; Нарушение авторских прав?; Мы поможем в написании вашей работы!