КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Добрива
|
|
|
|
| мінеральні | органічні | ||
| Селітри, рідкий амоніак, солі амонію та ін. | Гній, послід, зелені добрива | ||
| Класифікація елементів, що входять до складу добрив | |||
| Мaкроелементи (Нітроген, Фосфор, Калій) | Проміжні елементи (Кальцій, Магній, Сульфур) | Мікроелементи (Бор, Купрум, Ферум, Манган, Молібден, Цинк) | |
| Характеристика добрив | |||
| Назва | Хімічна формула | Вміст основної поживної речовини | |
| Фосфатні добрива | |||
| Фосфоритне борошно | Ca5F(PO4)3 | P2O5 ― 19-25 % | |
| Суперфосфат простий | Ca(H2PO4)2 ∙ H2O + Н3РО4 +
+ CaSO4 | P2O5 ― 16-20 % | |
| Суперфосфат подвійний | Ca(H2PO4)2 ∙ H2O + Н3РО4 | P2O5 ― 38-50 % | |
| Нітратні добрива | |||
| Амоніакова селітра (амоній нітрат) | NН4NO3 | N ― 32-35 % | |
| Амоній сульфат | (NH4)2SO4 | N ― 20-21 % | |
| Натрієва селітра (натрій нітрат) | NaNO3 | N ― 16 % | |
| Хлористий амоній (амоній хлорид) | NН4Cl | N ― 24-25 % | |
| Сечовина | CO(NH2)2 | N ― 42-46 % | |
| Калійні добрива | |||
| Хлористий калій (калій хлорид) | KCl | K2O ― 50-62 % | |
| Калій сульфат | K2SO4 | K2O ― 48-52 % | |
| Каїніт | KCl ∙ MgSO4 ∙ 3H2O + NaCl | K2O | |
| Змішані та складні добрива | |||
| Нітрофоска | NН4NO3 + CaHPO4 + + СаСО3 + KCl або NН4NO3 + CaHPO4 + + (NH4)2HPO4 + CaSO4 ∙ ∙ 2H2O + KCl або NН4NO3 + (NH4)2HPO4 + + KCl | N ― 12-20 % P2O5 ― 10-14 % K2O ― 10-21 % | |
| Амофоска | (NH4)2HPO4 ∙ (NH4)2SO4 + + KCl | N ― 11-12 % P2O5 ― 11-16 % K2O ― 15-20 % | |
Характеристика мікроелементів
| Мікроелемент | Значення для рослин | Вміст у добривах |
| Бор | Нестача в ґрунті спричиняє за-хворювання в рослин (відми-рання верхівки у льону, гниль серцевини кормового буряка та ін.); знижує врожайність | 1. У борній кислоті (Н3ВО3) та бурі (Na2B4O7). 2. Зола, торф, гній (1кг золи містить 200 – 700 мг Бору, 1 кг гною і торфу – близько 20 мг Бору |
| Цинк | Нестача призводить до захво-рювання рослин (зменшення розмірів листків та їх знебар-влення), вповільнення їх росту | 1. Промислові відходи. 2. Сірчанокислий та хлористий цинк |
| Манган | Нестача в ґрунті спричиняє жовтизну листків картоплі, капусти, томатів. На відсутність Мангану особливо реагують пшениця, овес, кукурудза, пло-дові рослини | 1. Марганцеве добриво одержують зі шламу (MnO2, MnO та органічні речовини). 2. Манган сульфат, манган хлорид, манган нітрат |
| Купрум | Відсутність у ґрунті спричиняє захворювання у злаків – “білу чуму”; чутливі до нестачі Куп-руму злаки, плодові дерева | 1. Купрумовмісні руди. 2. Мідний купорос |
НЕМЕТАЛИ ЧЕТВЕРТОЇ ГРУПИ
ЕЛЕМЕНТИ VІ ГРУПИ ГОЛОВНОЇ ПІДГРУПИ
КАРБОН ТА СИЛІЦІЙ
Порівняльна характеристика будови атомів
Карбону та Силіцію
| Атом Карбону С | Атом Силіцію Si | ||||
| Розміщення електронів на енергетичних рівнях | +⑥)) 2 4 | +⑮))) 2 8 4 | |||
| Електронна формула | 1S22S22P2 | 1S22S22P63S23P2 | |||
| Розміщення електронів на орбіталях |
2S2 2P2
|
3S2 3P2
   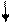           3d0
3d0
|
| Розміщення електронів на орбіталях в атомах Карбону | Ступінь окиснення | |
| Можливі ступені окиснення Карбону |
1S2 2S2 2P2
 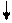  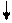 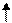                  +6С
1S2 2S1 2P3 +6С
1S2 2S1 2P3
                      +6С +6С
| +2 ―4; +4 |
Особливості алотропних форм вуглецю
| Алмаз | Графіт | Карбін |
| У кристалічній гратці ко-жен атом Карбону оточе-ний чотирма іншими. Атоми розміщені на од-накових відстанях один від одного і дуже міцно зв’язані між собою кова-лентними зв’язками. Цим пояснюється значна твердість алмаза | Атоми Карбону розмі-щені паралельними ша-рами. Відстань між сусід-німи шарами набагато більша, ніж між сусід-німи атомами в шарі. Це зумовлює незначну міц-ність зв’язку між шарами, тому графіт легко розще-плюється на тонкі лусоч-ки, які самі по собі до-сить міцні | Це чорний порошок із включеннями більших за розмірами кристалів зі скляним блиском. Крис-тали карбіну складають-ся з ланцюжків атомів Карбону, сполучених одинарними та потрій-ними зв’язками, що чер-гуються. За твердістю пе-реважає графіт, але по-ступається алмазу |
Порівняльна характеристика Карбону та Силіцію
| Ознаки для порівняння | Карбон | Силіцій |
| Поширення в природі | Зустрічається в природі як у вільному стані (вміст у земній корі – 0,02 %), так і у сполуках (переважно в карбонатах). У вільному кристалічному стані зуст-річається у вигляді алмазу (окремі кристали) та гра-фіту (утворює потужні пок-лади) | У вільному стані не зустрі-чається. Головні природні сполуки: силіцію діоксин та солі силіцієвих кислот. Другий за поширеністю в природі елемент (29,5% маси земної кори) |
| Фізичні властивості | Утворює кілька алотропних форм, які відрізняються фізичними властивостями | Тверда речовина з харак-терним блиском. Існує в аморфному та кристаліч-ному станах. Гарний напів-провідник |
| Хімічні властивості а) взаємодія з металами; б) взаємодія з неметалами (киснем, воднем) в) відновні влас-тивості (легко відновлює мета-ли з їх оксидів у процесі нагріва-ння) | 4Al + 3C → AL4C3 алюміній карбід 2С + O2 → 2СO карбон (ІІ) оксид С + O2 → СO2 карбон (ІV) оксид C + 2H2 → CH4 метан ZnO + C → Zn + CO | 3Ca + Si → Ca2Si кальцій силіцій Si + O2 → SiO2 Si + 2H2 → SiH4 силан ― |
| Застосування | Алмаз застосовують: для різання скла; для свердління твердих порід: у ювелірній справі (добре відшліфовані прозорі кристали – діаманти – є коштовним камінням). Графіт застосовують: в електротехніці для виготовлення електродів; як мастильний матеріал; для виробництва грифелів для олівців | Силіцій застосовують: як напівпровідник; у металур-гії (як відновник, а також для одержання кислото-тривких сталей); для ви-робництва сонячних бата-рей, які перетворюються сонячну енергію на елект-ричну |
Вуглецеві матеріали
| Кокс | Деревне вугілля | Сажа | Природне вугілля |
| Твердий пористий матеріал, який одержують шля-хом прожарюван-ня вугілля без дос-тупу повітря. Скла-дається переваж-но з чистого вугле-цю. Використову-ється як паливо, відновник – у ме-талургії | Форма вуглецю, яку одержують у результаті прожа-рювання дереви-ни або інших ма-теріалів рослин-ного або тварин-ного походження без доступу повіт-ря. Використову-ється як вбирач газів | Карбоновмісний продукт непов-ного згоряння, що складається з час-тинок чорного ко-льору. Застосову-ється в лакофар-бовій, поліграфіч-ній промислово-сті, як наповнювач у процесі вулкані-зації каучуку | Природний про-дукт з високим умістом Карбону. Найдавніше дже-рело енергії. Яв-ляє собою міне-рал, що утворився з речовин рослин-ного походження. Існує кілька видів вугілля: буре вугі-лля, кам’яне вугі-лля, антрацит (найбагатший на Карбон) |
Основні види палива
| Газоподібне | Рідке | Тверде |
| Природний, водяний, коксовий гази | Нафта та нафтопродукти | Деревина, кам’яне вугілля, буре вугілля, торф, горючі сланці |
Характеристика адсорбції
| Адсорбція – поглинання поверхнею адсорбента розчинених речовин. |
| Процес адсорбції протікає тим інтенсивніше, чим більшою є поверхня адсорбенту. Для збільшення поверхні адсорбент подрібнюють або роблять пористим | Адсорбенти: деревне вугілля, активоване вугілля |
| Активоване вугілля використовують: для очищення повітря від отруйних речовин (це було використано М.Д. Зелінським у фільтрувальному протигазі в період Першої світової війни); для вловлювання бензину з природних газів; у вигляді таблеток застосовують у разі отруєнь та шлункових захворювань для виведення шкідливих речовин з організму; як каталізатор |
Порівняльна характеристика
карбон (ІІ) оксиду та карбон (ІV) оксиду
| Ознаки для порівняння | Карбон (ІІ) оксид СO (чадний газ) | Карбон (ІV) оксид СO2 (вуглекислий газ) |
| Фізичні властивості | Безбарвний газ, без запаху, трохи легший за повітря, ма-лорозчинний у воді, на пові-трі горить блакитнуватим полум’ям | Безбарвний газ, без запаху, у 1,5 раза важчий за повітря, добре розчинний у воді |
| Фізіологічна дія | Отруйний. Його отруйна дія полягає в тому, що він нео-боротно взаємодіє з гемо-глобіном крові, яка після цього втрачає здатність пе-реносити кисень від легень до тканин | Не отруйний, але люди та тва-рини в разі великої його кон-центрації задихаються: в разі 3%-ї концентрації у повітрі в людини спостерігається часте дихання, а в разі 10%-ї – втрата свідомості та смерть |
| Промисловий спосіб одержання | Одержують шляхом газифі-кації твердого палива:
СО2 | Одержують з допомогою термічного розкладу вапняку або крейди: СаСО3 → СаО + СО2 Також одержують, спалюючи вугілля, торф, нафтопродукти та ін.. |
| Застосування | Входить до складу штучного газоподібного палива, а та-кож використовується в ор-ганічному синтезі | У промисловості для одержан-ня соди, виготовлення безал-когольних напоїв |
Солі карбонатної кислоти
| Карбонати | Гідрогенкарбонати |
| Na2CO3 – натрій карбонат | NaHCO3 – натрій гідрогенкарбонат |
| CaCO3 – кальцій карбонат | Ca(HCO3)2 – кальцій гідрогенкарбонат |
Хімічні властивості карбонатів
| Розклад у наслідок нагрівання | CaCO3→ СаО + СО2 Ca(HCO3)2 → CaCO3 + СО2 + H2O |
| Взаємодія із солями | К2СО3 +CaСl2 → CaCO3↓ + 2KCl |
| Якісна реакція: взаємодія карбонатів і гідрогенкарбона-тів із хлоридною кислотою з бурхливим виділенням вугле-кислого газу | К2СО3 +2НСl → 2NaCl + СО2↑ + H2O КHСО3 +НСl → KCl + СО2↑ + H2O |
| Взаємоперетворення карбонатів і гідрогенкарбонатів | |
н.у.
  CaCO3 + СО2 + H2O Ca(HCO3)2
Нагрівання CaCO3 + СО2 + H2O Ca(HCO3)2
Нагрівання
|
Види твердості води
| Твердість води зумовлюється наявністю, головним чином, солей Кальцію та Магнію | |
| Карбонатна (тимчасова) твердість пов’язана з наявністю гідрогенкарбо-натів Кальцію та Магнію | Некарбонатна (постійна) твердість пов’язана з наявністю сульфатів і хлоридів Кальцію і Магнію |
| Способи усунення: | |
| 1) дією натрій карбонату: Ca(HCO3)2 + Na2CO3 → CaCO3 + 2NaНСО3 2) дією кальцій гідроксиду: Ca(HCO3)2 + Са(ОН)2 → 2CaCO3↓ + 2H2O 3) кип’ятінням: Ca(HCO3)2 → CaCO3 ↓+ СО2↑ + H2O Mg(HCO3)2 → MgCO3↓ + СО2 ↑+ H2O | Усувають дією натрій карбонату: CaSO4 + Na2CO3 → CaCO3↓ + Na2SO4 MgSO4 + Na2CO3 → MgCO3↓ + Na2SO4 |
Застосування карбонатів
| Назва солі | Хімічна формула | Властивості | Застосування |
| Калій карбонат (поташ) | К2СО3 | Білий, гігроскопічний порошок, розчинний у воді | Використовується у виробництві скла та рідкого мила |
| Натрій карбонат (сода) | Na2CO3 | Білий порошок або білі кристали, добре розчинні у воді | У виробництві хімічних продуктів, у милова-рінні, скляній, тексти-льній промисловості, у побуті |
| Натрій гідрогенкарбонат (питна сода) | NaHCO3 | Білий порошок добре розчинний у воді, внаслідок нагрівання розкладається на натрій карбонат, воду та карбон (ІV) оксид | У медицині, хлібопе-ченні, для наповнення вогнегасників |
| Кальцій карбонат | CaCO3 | У воді практично нерозчинний | Як будівельний мате-ріал, для одержання кальцій оксиду та вуг-лекислого газу |
Хімічні властивості силікатів
| Взаємодія з кислотами | Na2SiO3 + H2SO4 → Na2SO4 + H2SiO3↓ |
| Взаємодія з солями | Na2SiO3 + CaCl2 → 2NaCl + CaSiO3↓ |
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 746; Нарушение авторских прав?; Мы поможем в написании вашей работы!