КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Флуору та Хлору
|
|
|
|
| Атом Флуору F | Атом ХлоруCl | ||||
| Розміщення електронів на енергетичних рівнях | +⑨)) 2 7 | +⑰))) 2 8 7 | |||
| Електронна формула | 1S22S22P5 | 1S22S22P63S23P5 | |||
| Розміщення електронів на орбіталях |
      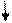                 1S2 2S2 2P5 1S2 2S2 2P5
| 3S2 3P5
                 3d0
3d0
|
З підвищенням порядкового номера елементів в ряду F – At збільшуються радіуси атомів, зменшується електронегативність, слабкішають неметалічні властивості й окиснювальна здатність елементів.
У вільному стані галогени складаються з двоатомних молекул. Збільшення кількості електронних шарів атомів галогенів викликає послідовну зміну їх властивостей. Змінюється інтенсивність забарвлення та агрегатний стан.
F2 – блідо-зелений газ
СІ2 – жовто-зелений газ
Br2 – темно-червона рідина
І2 – коричнево-фіолетові кристали
У твердому стані галогени мають кристалічну решітку молекулярного типу. Тому вони легкоплавкі та леткі. Температура кипіння та плавлення різко підвищується від фтору до йоду.
Окислювальна активність вільних галогенів змінюється таким чином:
F2 → СІ2 → Br2 → І2 →
зниження окислювальної здатності
Найбільш сильним окисником є фтор. Він безпосередньо утворює сполуки майже з усіма елементами, навіть з деякими інертними газами (ксенон, криптон). Фтор не окислює лише кисень, азот, гелій, неон, аргон, алмаз. Майже всі елементарні речовини спалахують в атмосфері фтору.
Хлор теж сильний окисник, але перед фтором поступається. Вільні галогени виявляють надзвичайно високу хімічну активність. Вони реагують з усіма простими речовинами.
11. Взаємодія з металами:
2Na + Cl2 → 2NaCl
Cu + Cl2 → CuCl2
12. Взаємодія з неметалами:
2P +3Cl2 → 2PCl3
Si + 2F2 → SiF4
H2 + Cl2 → 2HCl
13. Окиснюють складні сполуки:
2FeCl2 + Cl2 →2FeCl3
H2S + I2 → S↓ + 2HI
Na2SO3 + Br2 + H2O → Na2SO4 + 2HBr
Дуже енергійно відбувається взаємодія фтору із складними речовинами. У його атмосфері горять такі стійкі речовини, як скло і водяна пара:
SiО2 + 2F2 → SiF4 + О2
2H2O + 2F2 → 4НF + О2
Хлор безпосередньо з киснем не сполучається. Всі оксигеновмісні сполуки хлору добувають непрямим способом. Оксигеновмісні кислоти Хлору нестійкі. Всі є окисниками. Зі збільшенням позитивного ступеня окиснення стійкість кислоти зростає, а окисні властивості зменшуються.
Найсильнішими окисниками є найменш стійкі кислоти: гіпохлоритна НСІО, хлоритна НСІО2. Солі всіх оксигеновмісних кислот Хлору стійкі. Гіпохлоритна кислота (слабка) утворюється при розчиненні у воді хлору:
H2O + СІ2 → НСІ + НСІО.
Хлоратна кислота НСІО3 – сильна кислота, існує лише в водних розчинах. Утворюється при розкладанні НСІО:
3НСІО → НСІО3 + 2НСІ.
Ще її добувають дією H2SO4 на барій хлорат:
Ba(ClO3)2 + H2SO4 → BaSO4 + 2HClO3
6KOH + 3СІ2 → 5KСІ + KСІО3 + 3H2O
(калій хлорат – бертолетова сіль)
Перхлоратна кислота НСІО4 – сильна кислота, сильний окисник. Утворюється при взаємодії концентрованої H2SO4 та калій перхлорату:
KСІО4 + H2SO4 → КНSO4 + НСІО4.
? Тестові завдання
Тема. НЕМЕТАЛИ VІІ ГРУПИ
1. Вкажіть тип хімічного зв’язку хлороводню:
а) металічний б) полярний ковалентний
в) йонний г) неполярний ковалентний
д) водневий
2. Вкажіть формулу речовини, яка взаємодіє з хлором
а) H2SO4 (розб.) б) KOH
в) NaF г) H3PO4
д) KCLO3
3. Вкажіть галоген, який не трапляється в природі
а) Бром б) Хлор
в) Йод г) Астат
д) Флуор
4. Вкажіть галогенід – йон, у якого відсутні відновні властивості
а)Cl − б) F −
в) Br − г) I −
д) At −
5. Окисні властивості атомів і молекул галогенів у підгрупі зверху донизу….
а) зростають б) спадають
в) не змінюються г) спочатку збільшуються, а потім зменшуються
д) спочатку зменшуються, а потім збільшуються
6. Вкажіть формулу найслабкішої галогеноводневої кислоти:
а) HBr б) HF
в) HI г) HCl
7. Вкажіть формулу речовини, з якою, на відміну від хлоридної, взаємодіє плавикова кислота:
а)CaO б) SIO2
в) Mg г) KOH
д) KNO3
8. Вкажіть формулу реактиву, який використовується для виявлення будь – якого галогеніду (окрім фториду):
а) BaCl2 б) Zn(NO3)2
в) AgNO3 г) HCl
д) KNO3
9. Вкажіть речовину, з якою не реагує бромна вода:
а) стирен б) бензен
в) ацетилен г) етилен
д) фенол
10. Фтор і хлор, на відміну від інших галогенів:
а) є рідинами б) легко горять на повітрі
в) токсичні г) добре проводять електричний
д) є газами
11. Допишіть схему реакції Сl2 +NaOH →. Вкажіть суму молярних мас продуктів реакції:
а) 142 б) 133
в) 151 г) 113
д) 125
12. Складіть рівняння реакції, що відбувається під час пропускання хлору через гарячий розчин калій гідроксиду. Вкажіть суму всіх коефіцієнтів:
а) 13 б) 17
в) 16 г) 15
д) 18
13. Напишіть рівняння реакцій хлору з фосфором, враховуючи два можливі випадки. Вкажіть суму всіх коефіцієнтів:
а) 16 б) 7
в) 18 г) 15
д) 21
14. Обчисліть і вкажіть, який об’єм хлору (н.у.) окиснить 0,45 моль заліза:
а) 8,96л б) 10,08л
в) 6,72л г) 3,36л
д) 15,12л
15. Складіть схему електронного балансу та завершіть рівняння реакції, схема якої: Br2 + Cl2 + H2O → HBrO3 + HCl. Вкажіть суму всіх коефіцієнтів.
а) 20 б) 22
в) 24 г) 20
д) 23
16. Розставте коефіцієнти у схемі окисно–відновній реакції методом електронного балансу: NaClO3 + MnO2 + NaOH → NaCl + Na2MnO4 + H2O. Вкажіть суму всіх коефіцієнтів.
а) 19 б) 16
в) 17 г) 20
д) 22
17. Встановіть відповідність між реагентами і продуктами реакції.
А. Cl2 + KOH → t 1. KСlO + KCl + H2O
Б. Cl2 + H2O → 2. HClO3 + HCl
В. Cl2 + KOH → 3. KClO3 + KCl + H2O
4. HClO + HCl
18. У результаті повного електролізу 250 г розчину натрій хлориду на аноді виділилося 13,44 л (н.у.) хлору. Визначте масову частку NaCl у вихідному розчині:
а) 27,3% б) 28,1%
в) 16,8% г) 23,9 %
д) 26,4%
19. Встановіть послідовність зростання сили кислот:
а) HClO3 б) HClO
в) HClO4 г) HClO2
20. Встановіть послідовність зростання неметалічних властивостей елементів, атоми яких мають таку конфігурацію зовнішнього електронного шару:
а) ……5s25p5 б) …..4s2 4p5
в) ….. 2s22p5 г) ….6s26p5
д) ….3s23p5
21. Вкажіть назви речовин, які взаємодіють із хлоридною кислотою: 1) мідь; 2) сульфур (ІV) оксид; 3) натрій гідроксид; 4) купрум (ІІ) оксид; 5) сульфатна кислота; 6) цинк
а) 2,4,6 б) 3,4,6
в) 3,5,6 г) 1,3,4
22. На взаємодію 11,2г суміші заліза й міді витратили хлор, одержаний дією хлоридної кислоти (взятої у надлишку) на 17,4г манган (IV) оксиду. Визначте кількість речовини міді, яка містилася у вихідній суміші.
23. Під час розчинення у хлоридній кислоті еквімолярної суміші калій карбонату та кальцій гідрогенкарбонату утворилося 13,44л газу (н.у.). Визначте масу вихідної суміші.
24. На розчинення еквімолярної суміші ферум (ІІІ) оксиду та цинк оксиду витратили хлоридну кислоту, одержану 1,792л хлороводню. Визначте масу вихідної суміші оксидів.
25. На суміш алюмінію, силіцію та магній оксиду, маса якої становить 5г, подіяли хлоридною кислотою, взятою у надлишку. У результаті виділилося 4,368л (н.у) газу та залишився 1г нерозчиненого залишку. Визначте масу магній оксиду у вихідній суміші.
Класифікація біоелементів. Біоелементи у періодичній
системі Д.І. Менделєєва.
Існує декілька різних класифікацій хімічних елементів, що містяться в живих організмах. Вернадський поділяв хімічні елементи за декадною системою по аналогії із вмістом елементів у земній корі.
Середня масова доля хімічних елементів у живій речовині (за
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 3641; Нарушение авторских прав?; Мы поможем в написании вашей работы!