
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Смеси идеальных газов
|
|
|
|
Если в замкнутый объем поместить несколько между собой химически инертных газов, то в результате их механического перемешивания образуется субстанция с новыми термодинамическими свойствами, которая называется газовой смесью.
Если обозначить массу, объем и давление газовой смеси соответственно mсм, Vсм и pсм, то эти параметры можно выразить через соответствующие параметры компонентов, составляющих эту смесь:
mсм= m1+ m2+…+mn =åmi - масса смеси;
Vсм= V1+V2+…+Vn =åVi - объем смеси;
pсм=p1+p2+…+pn=åpi - давление смеси, (закон Дальтона)
В вышеприведенных формулах суммирование ведется в пределах: i=1,2…n, где n - число компонентов, из которых состоит газовая смесь;
mi – масса i- го компонента; Vi, pi – приведенный объем и парциальное давление iго компонента смеси.
В термодинамике применяются следующие понятия:
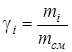 - массовая доля i- го компонента;
- массовая доля i- го компонента;
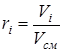 - объемная доля i- го компонента.
- объемная доля i- го компонента.
Очевидна правомерность следующих равенств: 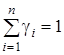 и
и 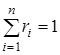 , где суммирование ведется по i =1, 2…n.
, где суммирование ведется по i =1, 2…n.
Мольная (кажущаяся) масса смеси определяется по одной из следующих формул
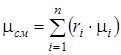 ;
; 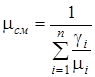 . (1.17)
. (1.17)
Газовая постоянная смеси определяется по следующим формулам:
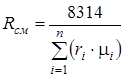 ;
; 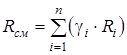 , (1.18)
, (1.18)
где 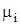 и
и 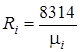 - соответственно мольная масса и газовая постоянная i- го компонента смеси.
- соответственно мольная масса и газовая постоянная i- го компонента смеси.
Смесь количественно может быть задана в массовых gi и объемных ri долях. Связь между gi и ri выражается при помощи следующих формул:
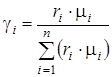 ,
, 
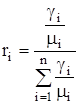 . (1.19)
. (1.19)
В смеси, находящейся в термодинамическом равновесии, температура в пределах всего объема Vсм всюду одинакова, обозначим ее Tсм. Если все компоненты газовой смеси соответствуют определению идеального газа, то термодинамическое состояние этой смеси описывается уравнением Клапейрона-Менделеева:
pсм×Vсм=mсм×Rсм×Tсм. (1.20)
При тепловых расчетах часто приходится иметь дело со смесями газов. В подобных случаях возникает необходимость определения теплоемкости смеси. В термодинамических таблицах приводятся только теплоемкости отдельных компонентов смеси.
Существуют формулы, позволяющие определять эти величины. В зависимости от того, как задана смесь, удельную теплоемкость смеси можно рассчитывать при помощи формул:
смесь задана массовыми долями 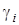 :
:
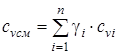 - изохорная массовая удельная теплоемкость смеси; (1.21)
- изохорная массовая удельная теплоемкость смеси; (1.21)
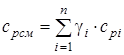 - изобарная массовая удельная теплоемкость смеси; (1.22)
- изобарная массовая удельная теплоемкость смеси; (1.22)
в случае задания смеси в объемных долях 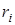 :
:
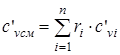 - изохорная объемная удельная теплоемкость смеси; (1.23)
- изохорная объемная удельная теплоемкость смеси; (1.23)
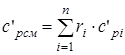 - изобарная объемная удельная теплоемкость смеси, (1.24)
- изобарная объемная удельная теплоемкость смеси, (1.24)
где соответственно обозначают 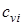 ,
, 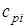 , и
, и 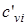 ,
, 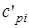 - массовые изохорная, изобарная и объемные изохорная, изобарная теплоемкости i-го компонента смеси, значения которых приведены в специальных таблицах в [9].
- массовые изохорная, изобарная и объемные изохорная, изобарная теплоемкости i-го компонента смеси, значения которых приведены в специальных таблицах в [9].
|
|
|
|
|
Дата добавления: 2014-12-07; Просмотров: 458; Нарушение авторских прав?; Мы поможем в написании вашей работы!