
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Изопараметрические процессы
|
|
|
|
Большое значение для теоретических исследований и решения практических задач имеют так называемые изопараметрические процессы, протекающие при постоянном (фиксированном) значении одного из параметров состояния и адиабатный процесс, который протекает без теплообмена с окружающей средой.
Термодинамические процессы удобно иллюстрировать в виде соответствующих линий (кривых) процесса на двумерных фазовых диаграммах. Широкое распространение имеют pv-, Ts-, hs -диаграммы, которые условно показаны на рис. 1.2.
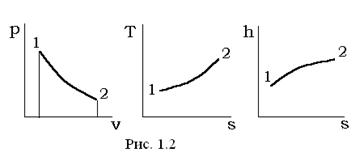
В общем случае расчет любого термодинамического процесса 1-2 при заданных начальных параметрах (p1, v1, T1) должен сводиться к определению конечных параметров (p2, v2, T2) состояний газа (рабочего тела) и вычислению участвующей в процессе теплоты q1-2, изменению внутренней энергии Δu=u2-u1, энтальпие Δh=h2-h1, энтропие Δs=s2-s1 и работе деформации объема рабочего тела l1-2. Таким образом, рассматриваемый процесс однозначно характеризуется значениями следующих функций процесса, параметров состояния и функций состояния:
(p1, v1, T1, p2, v2, T2, Δu, Δh, Δs, q1-2, l1-2). (1.37)
Очевидно, что перечисленный спектр величин должен быть дополнен сведениями о физической природе рабочего тела (cp, cv, μг и т.д.).
Следует отметить, что на pv -диаграмме линии процесса описываются уравнением p·vn= const. (Каждому термодинамическому процессу соответствует свое значение показателя политропы n).
Определим уравнение, описывающее линии процесса на T s-диаграмме.
 Для этого рассмотрим совместно следующие выражения (1.9) и (1.2):
Для этого рассмотрим совместно следующие выражения (1.9) и (1.2):
δq=сdT,
δq=Tds.
Учитывая равенство левых частей этих выражений, приравниваем их правые части:
сdT= Tds.
В полученном дифференциальном уравнении производим разделение переменных и осуществляем интегрирование
dT/T=ds/c 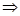

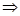
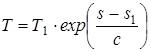 , (1.38)
, (1.38)
где T1, s1 – соответствуют началу процесса; с – теплоемкость рассматриваемого процесса.
Ниже приведены математические зависимости и фазовые диаграммы, необходимые для анализа и осуществления соответствующих расчетов при исследовании конкретных изопараметрических процессов.
При анализе каждого из изопараметрических процессов необходимо определить значения показателя политропы, теплоемкости процесса и изменения функций состояния, а также величину теплоты, принимающей участие в данном процессе и работу расширения, совершаемый ТДС при протекании рассматриваемого процесса.
I. Изохорный процесс v= const, dv=0.
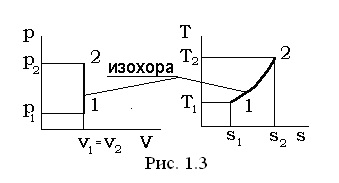
В уравнении линии процесса p×vn= const, (p1/n v= const) условие v= const удовлетворяется при n=¥, а теплоемкость изохорного процесса в соответствии с выражением равна 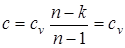 .
.
Из уравнения состояния идеального газа p×v=Rг×T (при условии v=const) следует
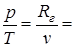 const
const  .
.
Перечень величин, представленных в выражении (1.37) в изохорном процессе, взаимосвязан следующими соотношениями:
p1×T2 = p2 ×T1; (1.39)
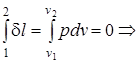 l1-2= 0, v1= v2; (1.40)
l1-2= 0, v1= v2; (1.40)
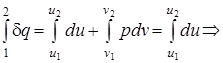 q1-2= u2 - u1; (1.41)
q1-2= u2 - u1; (1.41)
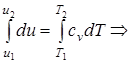 Δu=u2 - u1= cv× (T2 -T1); (1.42)
Δu=u2 - u1= cv× (T2 -T1); (1.42)
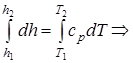 Δh=h2 - h1=cp× (T2 -T1); (1.43)
Δh=h2 - h1=cp× (T2 -T1); (1.43)
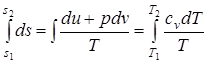
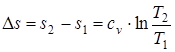 ; ( 1.44 )
; ( 1.44 )
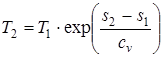 . (1.45)
. (1.45)
II. Изобарный процесс p= const, dp=0
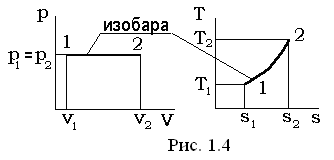
В уравнении политропного процесса p×vn= const, условие р = const удовлетворяется при n = 0; теплоемкость равна 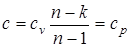 .
.
Из уравнения состояния p×v=Rг×T (при условии p= const) следует 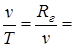 const,
const, 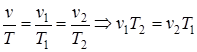 .
.
Соотношения между величинами, представленными в перечне (1.37), определяются путем интегрирования соответствующих выражений, как это производилось при рассмотрении изохорного процесса и имеют окончательный вид:
v1×T2= v2× T1; (1.46)
q1-2= h2 - h1; (1.47)
l1-2= p1× (v2 - v1) = p2× (v2 - v1); (1.48)
Δu=u2 - u1= cv× (T2 -T1); (1.49)
Δh=h2 - h1=cp× (T2 -T1); (1.50)
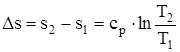 . (1.51)
. (1.51)
III. Изотермический процесс Т= const, dТ=0.
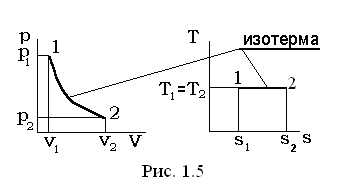
В уравнении политропного процесса T×vn-1= const, условие Т= const удовлетворяется при n = 1, а теплоемкость для этого случая определяется из выражения 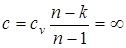 .
.
Из уравнения состояния p×v=Rг×T (при условии T= const) следует p×v=Rг×T = const, pv = p1 v1 = p2 v2Þ p1 v1= p2 v2.
Перечень величин (1.37) в изотермическом процессе взаимосвязан следующими соотношениями:
p1× v1 = p2×v2; (1.52)
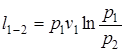 ;
; 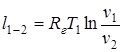 (1.53)
(1.53)
q1-2= l1-2; (1.54)
Δu=u2 - u1= 0; (1.55)
Δh=h2 - h1=0; (1.56)
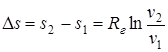 ; (1.57)
; (1.57)
T2=T1. (1.58)
|
|
|
|
|
Дата добавления: 2014-12-07; Просмотров: 906; Нарушение авторских прав?; Мы поможем в написании вашей работы!