
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теорія електролітичної дисоціації
|
|
|
|
Хімічний аналіз неорганічних сполук ґрунтується на хімічних реакціях і, звичайно, проводиться у водних розчинах. За більшістю випадків у хімічному аналізі використовують іонні реакції, тобто реакції між іонами. Взаємодія між протилежно зарядженими іонами проходить практично швидко, миттєво. А всі особливості водних розчинів при якісному аналізі (проводять електричний струм – електроліти, киплять при більш високих, а замерзають при більш низьких температурах ніж електроліти, тощо) пояснює теорія електролітичної дисоціації (ТЕД).
Теорія електролітичної дисоціації була запропонована в 1887р. Арреніусом, вона ґрунтується на наступних положеннях:
1. Молекули електролітів розпадаються в розчині на позитивно та негативно заряджені йони і цей процес називається електролітичною дисоціацією.
2. При розчиненні тільки визначна частина молекул розпадається на йони. Кількість молекул які розпалися на іони залежить від природи речовини та концентрації даної речовини в розчині.
В залежності від структури речовини яка розчинюється дисоціація відбувається за різними механізмами.
- дисоціація солей, тобто кристалів з іонною структурою (KCl, NaCl, BaCl2).
- розчинення речовин які складаються з полярних молекул. Цей процес прийнято називати – йонізацією.
Наприклад, при розчиненні соляної кислоти відбувається утворення іона гідроксонія: H2O+HCl=H3O++Cl-
Процес дисоціації практично не зворотній, а процес іонізації зворотній.
3.3. Кількісні характеристики процесу дисоціації. Кількісними характеристиками процесу дисоціації є ступінь дисоціації і константа дисоціації.
Електроліти – це речовини, розчини або розплави яких проводять електричний струм. Мірою сили електроліту є його здатність дисоціювати на іони.
Сильні електроліти – це електроліти, які практично повністю дисоціюють на йони (більшість неорганічних солей, кислот, луги).
Слабкі електроліти – не повністю дисоціюють на йони (більшість органічних сполук, H2CO3, HCN, H2SO4, NH4OH, CH3COOH).
CH3COOH ↔ CH3COO- +H+
Відповідно закону дії мас швидкість прямої реакції для даного рівняння буде:
V1=K1[CH3COOH]
А зворотної:
V2=K2[CH3COO-][H+]
В момент рівноваги: V1=V2
K1[CH3COOH]=K2[CH3COO-][H+]
K1/K2=[CH3COO-][H+]/[CH3COOH]=K
де К – константа рівноваги реакції або константа дисоціації. Константа дисоціації збільшується з підвищенням температури.
Наведене рівняння використовується для слабких, дуже розведених розчинів електролітів, а для електролітів які мають більшу концентрацію, або якщо в розчині присутні інші електроліти необхідно використовувати таке поняття як активність (а) замість концентрацій, тоді:
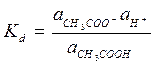 ,
,
Константа дисоціації яка визначається за активностями називається термодинамічною константою дисоціації. Для концентрованих розчинів, у випадку якщо відсутні дані про активності константу дисоціації розраховують за значеннями концентрацій, тоді розрахована константа називається умовною константою дисоціації.
Для характеристики стану слабкого електроліту в розчині використовують величину – ступінь дисоціації – α. Ступінь дисоціації прямо пропорційна кількості молекул які продисоціювали (Nd), та зворотно пропорційна загальної кількості розчинених молекул (Nр)
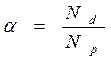
Ступінь дисоціації характеризує електроліт в розчині тільки визначеної концентрації та змінюється при її зміні. При підвищенні концентрації ступінь дисоціації як правило зменшується.
Для слабких електролітів вчений Оствальд встановив взаємозв’язок між константою дисоціації, ступенем дисоціації та молярною концентрацією розчина. Розглянемо цей взаємозв’язок на прикладі дисоціації оцтової кислоти:
CH3COOH ↔ CH3COO-+H+
Концентрація йонів які утворилися [CH3COO-] і [H+] можна записати як α×С, тоді концентрація непродисоційованих молекул буде С-αС або С(1-α)
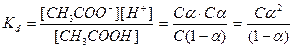
Це математичний вираз закону розведення Оствальда. В зв’язку з тим, що α для слабких електролітів дуже мала величина її значенням у знаменнику можна знехтувати, тоді:
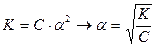
а якщо прийняти, що V=1/С – розведення розчину, тоді формула приймає вигляд:
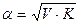 - Закон розведення Оствальда.
- Закон розведення Оствальда.
Величина ступеня дисоціації залежить:
1. Від температури (для багатьох електролітів з підвищенням температури ступінь дисоціації збільшується).
2. Від присутності інших йонів в розчині. Якщо в розчині є спільний йон (йон водню в суміші сильної та слабкої кислот), то в рівняння для константи дисоціації входить загальна концентрація цього йону. Ступінь дисоціації слабких електролітів значно зменшується при додаванні сильних електролітів, які мають спільний іон з слабкими електролітами. Якщо в суміші електролітів не має спільних іонів взаємний вплив електролітів виражений дуже слабо.
|
|
|
|
|
Дата добавления: 2014-12-07; Просмотров: 583; Нарушение авторских прав?; Мы поможем в написании вашей работы!