
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Реакції гідролізу
|
|
|
|
Рівноваги у розчинах солей, що гідролізують, та амфотерних сполуках.
Реакції гідролізу використовуються в якісному аналізі як характерні реакції відкриття ряду катіонів (наприклад: Sb3+, Bi3+, Fe3+) і аніонів (CH3COO-, SiO32-); для розділення Cr3+ і Al3+ - йонів; для регулювання рН і рОН розчинів (наприклад: додаванням катіонів чи аніонів – NH4+, CH3COO-). Залежно від складу солей розрізняють такі типи реакцій гідролізу:
1) Гідроліз солі, яка при дисоціації у водному розчині утворює катіон, який не виявляє поляризаційні та акцепторні властивості і аніон – сильний електронодонор (аніон слабкої кислоти – гідроліз за аніоном).
Приклад: CH3COONa + H2O ↔ CH3COOH + NaOH
CH3COO- +Na+ + H+OH- ↔ CH3COO- + H+OH-
CH3COO- + H+OH- ↔ CH3COOH + OH-
PH>7 лужне
2) Гідроліз солі, яка при дисоціації у водному розчині утворює катіон – сильний комплексоутворювач і аніон – слабкий електронодонор (катіон слабкої основи – гідроліз за катіоном)
Приклад: NH4Cl + H2O ↔ NH4OH + HCl
NH4+ + Cl- + H+OH- ↔ NH3 ·H2O + H+ + Cl-
NH4+ + H+OH- ↔ NH3 · H2O + H+
PH<7 кисле
3) Гідроліз солі, яка при досоціації у водному розчині утворює катіон – сильний комплексоутворювач і аніон – сильний електронодонор (катіон слабкої основи і аніон слабкої кислоти – гідроліз солі за катіоном і аніоном)
CH3COONH4 + H2O ↔ CH3COOH + NH4OH
CH3COO- + NH4+ + H+OH- ↔ CH3COOH + NH3 · H2O
Кількісно гідроліз характеризується ступенем гідролізу (h) і константою гідролізу (Кг).
Ступінь гідролізу (h) виражає відношення речовини солі Х (молярної концентрації речовини в моль/л), що прогідролізувала, до загальної кількості речовини Х (молярної концентрації моль/л)

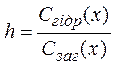 ,
,
 h - виражається в частках одиниці або у процентах (%)
h - виражається в частках одиниці або у процентах (%)
Константа гідролізу (Кг) показує відношення добутку молярних концентрацій речовин продуктів гідролізу до молярної концентрації речовин негідролізованих йонів солі у розчині (записують скорочене йонно-молекулярне рівняння реакції гідролізу).
|
|
|
|
|
Дата добавления: 2014-12-07; Просмотров: 861; Нарушение авторских прав?; Мы поможем в написании вашей работы!