
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Третiй тип гiдролiзу солей чи солеподібних сполук
|
|
|
|
Другий тип гiдролiзу солей чи солеподібних сполук.
Приклад, амонiй хлорид (NH4Cl):
NH4Cl + nH2O → NH 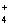 гiдр. + Cl–гiдр.
гiдр. + Cl–гiдр.
NH 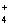 гiдр. + HOH ↔ NH3× H2O + H+гiдр.
гiдр. + HOH ↔ NH3× H2O + H+гiдр.
K г =  ; h =
; h = 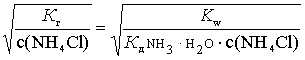
Якщо катiон високозарядний, то гiдролiз за катiоном проходить постадійно
Приклад, гiдролiз амонiй ацетату – CH3COONH4, коли гiдролiзує i катiон, i анiон:
CH3COONH4 + nH2O → CH3COO–гiдр. + NH 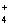 гiдр.
гiдр.
гiдратацiя i дисоцiацiя
CH3COO–гiдр. + NH 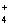 гiдр. + HOH ↔ CH3COOH + NH3× H2O
гiдр. + HOH ↔ CH3COOH + NH3× H2O
гiдролiз
K г = 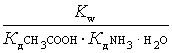 ,
, 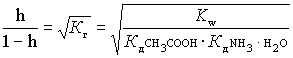
Фактори, що впливають на гідроліз: температура, концентрація солі, характер продуктів гідролізу, комплексоутворення, природа аніона.
Шляхи посилення гідролізу: розбавлення розчинів, підвищення температури, видалення продуктів гідролізу, додавання до розчину катіонів – сильних комплексоутворювачив і аніонів – сильних донорів пар електронів.
5.2. Значення гідролізу в якісному аналізі:
- реакції гідролізу використовують як характерні реакції відкриття цілого ряду катіонів і аніонів (Bi; Be; → Bi(OH)2 Cl↓, Be(OH)2 Cl; Al+3; SiO32-; CH3COO-)
- для розподілу йонів (для відділення Cr3+ від Al3+ додають надлишок лугу, при цьому утворюється Al33- і CrO33- а при подальшому кип’ятінні розчину хроміт гідролізується і утворює осад Cr(OH)3, а алюмінат ні.)
- для регулювання рН розчинів, які аналізуються (якщо додавати Na2CO3, CH3COONa збільшується [ОН-] і рН збільшується, а при додаванні NH4Cl збільшується [Н+] і рН знижується).
-
5. 3. Амфотерні гідроксиди
Амфотерність - виявлення сполуками як основних так і кислотних властивостей. Амфотерність покладена в основу кислотно-лужної класифікації катіонів, для виявлення окремих катіонів, для ідентифікації сполук.
Типові амфотерні гідроксиди: Be(OH)2, Zn(OH)2, Al(OH)3, Sn(OH)2, Pb(OH)2, Sb(OH)2, Cr(OH)3.
Всі амфотерні гідроксиди – тверді речовини, малорозчинні у воді, слабкі електроліти і не змінюють забарвлення індикаторів.
Приклад: Zn(OH)2
Основні властивості: Zn(OH)2 + 2Cl = ZnCl2 + 2H2O
Zn(OH)2 + 2H+ = Zn2+ + 2H2O
Кислотні властивості: Zn(OH)2 + 2NaOH = Na2ZnO2 + 2H2O
Zn(OH)2 + 2OH- = ZnO22- + 2H2O
В системі осад-розчин спостерігаються такі рівноваги:
2H+ + ZnO22- ↔ Zn(OH)2 ↔ Zn2+ + 2OH-
розчин осад розчин
Іонізація амфотерних гідроксидів характеризується двома константами: основною та кислотною.
Основна 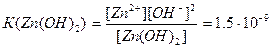
Кислотна 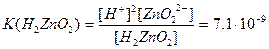
З цього можна зробити висновок, що Zn(OH)2 сильніше виявляє основні властивості ніж кислотні.
|
|
|
|
|
Дата добавления: 2014-12-07; Просмотров: 658; Нарушение авторских прав?; Мы поможем в написании вашей работы!