
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Буферні розчини
|
|
|
|
Хімічні реакції часто проходять з виділенням чи зв'язуванням гідроґен(1+)-іонів. А для проходження реакції необхідна стала концентрація гідроґен(1+)-іонів або стала величина pH.
Для створення і підтримання сталого рН реакційного середовища використовують буферні розчини, які перешкоджають зміні рН розчину при додаванні до нього сильної кислоти чи сильної основи.
Буферні розчини – це суміш слабкої кислоти і солі цієї кислоти, або суміш розчинів солей багатоосновних кислот різного ступеня заміщення:
1) ацетатна буферна суміш (CH3COOH(кислота)+CH3COONa(основа)), pH=4.76
2) аміачна буферна суміш (NH3·H2O(основа)+NH4Cl(кислота)), pH=9.25
3) фосфатна буферна суміш (NaH2PO4(кислота)+Na2HPO4(основа)), pH=6,6
4) карбонатна буферна суміш (NaHCO3(кислота)+Na2CO3(основа)), рН=6,68
Дія буферної системи ґрунтується на дії спільного йона:
CH3COOH ↔  СН3СОО-+Н+ (1)
СН3СОО-+Н+ (1)
СН3СООNa ↔ CH3COO-+Na+ (2)
При додаванні HNO3 ↔ H++NO3- у буферний розчин Н+ від HNO3 будуть зв’язуватися ацетат-іонами, які в основному утворюються за рівнянням (2)
Н+ + СН3СОО- ↔ CH3COOH
І рівновага реакції (1) майже не порушиться.
Якщо додавати NaОН, відбувається процес зв’язування Н+, які утворюються за (1) у слабкий електроліт Н+ + ОН- ↔ Н2О.
Кількість речовини кислоти або основи, яка при додаванні до буферного розчину викликає зміну рН на невелику певну величину, характеризує буферну ємність буферної системи.
Буферна ємність – це кількість речовини сильної кислоти або основи, яку необхідно додати до 1л розчину, щоб змінити рН на одиницю.
Буферна ємність залежить від:
1) Концентрації компонентів у розчині
2) Природи речовини, тобто КД кислоти чи основи.
3) Співвідношення концентрацій кислоти і солі чи основи і солі.
Значення рН будь-якої буферної системи обчислюють, виходячи із константи дисоціації (йонізації) кислоти чи основи і молярних концентрацій речовин.
1) рН ацетатної буферної системи:

[CH3COOH]=C (кислоти) [CH3COO-]=C (солі)
 ;
;
рН = -lg[H+]
Приклад: Знайти рН буферної системи, одержаної змішуванням 0,1 моль СН3СООН і 0,1 моль CH3COONa у 1л розчину.
С(СН3СООН)=С(CH3COONa)=0,1 моль/л
РН-?
Знаходимо в довіднику Кд(СН3СООН)=1,74·10-5

2) pH амiачної буферної системи: K д(NH3 H2O) =  ,
,
тоді [OH–] = K д основи 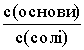 .
.
pOH = –lg[OH–], pH = 14 – pOH.
Буферні розчини широко використовуються у практиці якісного аналізу, коли необхідно забезпечити стале рН (Ni+2, Mg2+). Більшість процесів в організмі людини проходить при нейтральних рН, а підтримує рН – нейтральна система буферів.
|
|
|
|
|
Дата добавления: 2014-12-07; Просмотров: 3477; Нарушение авторских прав?; Мы поможем в написании вашей работы!