
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Приклад: визначити іонну силу 0,15М NaCl
|
|
|
|
Теорія сильних електролітів.
В термодинамічних розрахунках сильних електролітів використовують поняття іонної сили розчину – μ. Це величина враховує відхилення від закону дії мас, яке обумовлене концентрацією та зарядами іонів присутніми в розчині. Іонна сила розчину є мірою електростатичної взаємодії між іонами та вимірюється напівсумою добутку концентрації кожного з присутніх в розчині іонів на квадрат його валентності z, тобто:
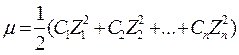 , або
, або 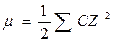
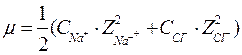
Після підстановки необхідних величин розраховуємо іонну силу даного розчину:
μ=0,5(0,15∙12+0,15∙12)=0,15
З одержаного результату видно, що при наявності в розчині однозарядних іонів, іонна сила чисельна дорівнює загальному молярному вмісту їх в розчині.
Розрахунки властивостей розчинів сильних електролітів ґрунтуються на використанні величині активності електроліту (а) або активна концентрація іона. У реальних розчинах активність іонів менша, ніж молярна концентрація речовини у розчині, причиною є сильна міжіонна взаємодія. Для врахування цієї взаємодії вводиться поняття про коефіцієнт активності (gх) іона:
gх = а(Х)/[Х]
Отже, а(Х) = [Х]gх, моль/дм3
Теорія електролітичної дисоціації разом з теорією сильних електролітів є основними в аналітичній хімії. Значення теорії електролітичної дисоціації і теорії сильних електролітів полягає в наступному:
а). завдяки ТЕД та теорії сильних електролітів всі аналітичні реакції можна розглядати як іонні. Тому рівняння аналітичних реакцій записують у іонно-молекулярній формі;
б). зробивши якісний аналіз та встановивши склад іонів, можна встановити формулу речовини і розрахувати склад речовини;
в). використовуючи поняття “ступінь дисоціації”, “константа дисоціації”, “активність”, “коефіцієнт активності”, можна розрахувати концентрації іонів та їх активність в розчинах, прогнозувати напрямок і повноту протікання реакції обміну і т.д.
3.5. Йонний добуток води. Шкала рН і рОН. В 1894 році німецький вчений Кольрауш встановив, що вода - слабкий електроліт, дисоціація якого відбувається за рівнянням: Н2О 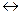 Н++ОН-
Н++ОН-
За законом дії мас записуємо:
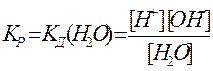
експериментально доведено, що при 25°С Кр=КД(Н2О)=1,86·10-16
Розраховуємо концентрацію води в 1л:
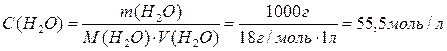
Рівняння для константи рівноваги можна записати:
KД×(H2O)·[H2O]=[H+][OH-] 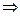 [H+][OH-] = 1.86·10-16·55.5 = 1·10-14 – іонний добуток води, Kw = 1·10-14, або Kw = [H+]·[OH-] = 1·10-7·1·10-7 = 1·10-14
[H+][OH-] = 1.86·10-16·55.5 = 1·10-14 – іонний добуток води, Kw = 1·10-14, або Kw = [H+]·[OH-] = 1·10-7·1·10-7 = 1·10-14
Характерно, що з підвищенням температури дисоціація води зростає, і значення іонного добутку теж зростає. Якщо [H+] = [OH-] середовище нейтральне
[H+] > [OH-] – кисле, [H+] < [OH-] – лужне.
Характеризувати середовище розчинів числами з від’ємними ступенями виявилося незручно, тому для практичного застосування введено водневий показник – рН. рН = -lg [H+] pH<7 - кисле
pH=7 - нейтральне
pH>7 - лужне
у розчині з pH=0, [H+]=1 моль/л
pH=14, [H+]=1·10-14 моль/л
Нижня межа рН лежить близько значення для 10 М розчину HCl, який має коефіцієнт активності 10,44: рН = - lg a (H+) = - lg (10×10.44) = - 2.02
Верхня межарН для 10 М розчину КОН, який має коефіцієнт активності 6,22: рOH = - lg a (OH-) = - lg (10·6.22) = - 1,79
рH = 14 – pOH = 14 – (- 1.79) = 15.79
Методи визначення рН:
1) Приблизне визначення проводять за допомогою хімічних індикаторів (лакмус, фенолфталеїн, метилоранж, універсальний індикаторний папір);
2) Для точного визначення використовують рН-метри (спеціальні приклади).
Для обчислення молярної концентрації використовують формули:
[H+] =10-рН моль/л, [OH-] =10-рОН моль/л
|
|
|
|
|
Дата добавления: 2014-12-07; Просмотров: 4125; Нарушение авторских прав?; Мы поможем в написании вашей работы!