
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Використання координаційних сполук
|
|
|
|
Координаційні сполуки широко використовуються в аналітичній хімії:
1) Для виявлення катіонів:
Fe3+ + [Fe(CN)6]4- + K+ → Kfe[Fe(CN)6]↓
2) Для стабілізації нестійких ступенів окислення атомів деяких хімічних елементів:
[SbCl6], [SnCl6]2-, [PbJ6]2- тощо.
3) Для відокремлення шостої і п’ятої груп катіонів під час системного аналізу катіонів шести аналітичних груп за кислотно-лужною системою аналізу:
[Al(OH)6]3-, [Cr(OH)6]3-, [Zn(OH)4]2- та інш.
4) Для розчинення осадів:
AgCl + 2NH3 ∙ H2O → [Ag(NH3)2]+ + Cl- + 2H2O
5) Для демаскування окремих йонів:
[Ag(NH3)2]Cl + 2H+ → AgCl + 2NH4+
6) Для зміни кислотно-основних властивостей
Al(OH)3 + 6F- → [AlF6]3- + 2NH4+
7) Для зміни окисно-відновних властивостей йонів:
2J- + 2Fe3+ → J2 + 2Fe2+
За законом дії мас процес дисоціації комплексного йона характеризується константою рівноваги, яка свідчить про стійкість комплексного йона і називається константою нестійкості комплексної сполуки.
[Ag(NH3)2]+ ↔ Ag+ + 2NH3
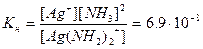
Чим менше значення Кн, тим більш стійка комплексна сполука, тим більший інтервал рН комплексоутворення, оскільки рН меншою мірою впливає на комплексоутворення.
Якщо комплексна сполука дисоціює в декілька стадій, то константи рівноваги цих проміжних реакцій називаються ступінчастими константами нестійкості. Величина, обернена константі нестійкості, називається загальною константою стійкості комплексної сполуки.
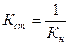
Шляхи руйнування комплексних сполук:
1) Зміна рН:
[Ag(NH3)2]+ + Cl- + 2H+ → AgCl↓ + 4NH3
[Zn(NH3)4]2+ + 4OH- → [Zn(OH)4]2- + 4NH3
2) Дія осаджувача:
[Cu(NH3)4]2+ + H2S → CuS + 2NH3 + 2NH4+
3) Дія окисника:
[Zn(NH3)4]2+ + 6Ocl- → Zn2+ + 2N2 + 6Cl- + 6H2O
4)  Розбавлення розчину:
Розбавлення розчину:
H2[CoCl4] CoCl2 + 2HCl
Голубий колір рожевий колір
Розчину розчину
Література
1. А.Т. Пилипенко, И.В. Пятницкий «Аналитическая химия», часть І. Москва, «Высшая школа», 1990 г.
2. А.Т. Пилипенко, И.В. П¢ятницкий «Аналитическая химия», часть ІІ, Москва, «Высшая школа», 1990.
3. Н.Я.Логинов, А.Г. Воскресенский, И.С. Солодкий «Аналитическая химия», Москва, «Просвещение», 1975 г.
4. В.П. Васильев ««Аналитическая химия», часть І. Москва, «Высшая школа», 1989 г.
5. В.П. Васильев ««Аналитическая химия», часть ІІ. Москва, «Высшая школа», 1989 г.
6. В.П. Васильев, Р.П. Морозова, Л.А. Кочергина. Аналитическая химия. Лабораторный практикум. – M.: Дрофа, 2004 – 416 c.
7. В.П. Васильев, Л.А. Кочергина, Т.Д.Орлова. Аналитическая химия. Сборник вопросов, упражнений и задач.– M.: Дрофа, 2003 –320 c.
8. В.П. Васильев, В.Е. Калинина, Л.А. Кочергина, А.Н.Куракин, П.М.Милюков, Г.А.Прик. Сборник вопросов и задач по аналитической химии. – M.: Высшая школа, 1976 – 216 c.
9. В.П. Васильев. Аналитическая химия. Книга 1 и 2. – M.: Дрофа, 2003. – 458 c.
10. Д.Д.Лучевич, А.С.Мороз, О.В.Грибальська. Аналітична хімія. Підручник. – К.:Медицина, 2009 – 416 с.
11. Т.В. Солодовнік „Аналітична хімія та інструментальні методи аналізу. Лабораторний практикум”, Черкаси: ЧДТУ, 2009, - 194 с.
12. А.С. Сегеда «Аналітична хімія. Якісний аналіз», Київ, ЦУЛ, 2002.
13. A.С. Сегеда. Аналітична хімія. Кількісний аналіз. – Київ: ЦУЛ. Фітосоціоцентр, 2006. – 544 c.
14. А.С. Сегеда. Р.Л. Галаган. Збірник задач і вправ з аналітичної хімії. Якісний аналіз. – Київ: ЦУЛ. Фітосоціоцентр, 2002. – 429 с.
15. А.С. Сегеда. Збірник задач і вправ з аналітичної хімії. Кількісний аналіз. – Київ: ЦУЛ. Фітосоціоцентр, 2005. – 491 c.
|
|
|
|
|
Дата добавления: 2014-12-07; Просмотров: 611; Нарушение авторских прав?; Мы поможем в написании вашей работы!