
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
ВВЕДЕНИЕ. По дисциплине: токсикология и медицинская защита
|
|
|
|
Тема № 7
По дисциплине: токсикология и медицинская защита
Учебное пособие
«Ядовитые технические жидкости»
Обсуждено на заседании
кафедры В и ЭМ НГМУ
«____» _________ 200 г.
Протокол №
г. Новосибирск 2009 г.
В настоящее время, практически во всех сферах производства: промышленности, сельском хозяйстве, а также в армии и на флоте, находят широкое применение различные вещества, которые используются в качестве растворителей, антифризов, горючего, сырья для получения других продуктов. Они получили название технических жидкостей.
Многие из веществ этой группы высокотоксичны, при определенных условиях они могут вызвать как острые, так и хронические отравления (при нарушении техники безопасности или аварийных ситуациях – отравления профессионального характера; прием технических жидкостей внутрь по ошибке или умышленно – бытовой характер).
В пособии разбераются физико-химические свойства, механизм действия клинику, профилактику и лечение наиболее часто встречающихся и тяжело протекающих отравлений.
Вещества, рассматриваемые во второй половине данного пособия относятся к разным группам: гетероциклическое, содержащее кислород, близкое к углеводородам соединение -этиленоксид (окись этилена); галоидзамещенные углеводороды жирного ряда -бромметил, хлорметил, йодметил; сложные эфиры – диметилсульфат; галогенированные ароматические углеводороды – диоксин.
Все они широко используются в народном хозяйстве для метилирования, как инсектициды, растворители, хладогенты в холодильных аппаратах, огнетушителях, и в случае аварии риск поражения этими веществами достаточно велик, что и заставляет тщательно изучить эти вещества – как вероятную причину отравления человека.
1.ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ТЕХНИЧЕСКИХ ЖИДКОСТЕЙ.
Метиловый спирт (древесный спирт, метанол, карбинол) СН3ОН – бесцветная жидкость, по запаху неотличимая от этилового спирта. Температура кипения 66°С. Удельный вес 0,792.. Плотность пара 1,106, хорошо растворим в воде.
Пути проникновения в организм: алиментарный, ингаляционный, кожно-резорбтивный. До 75% выделяется в неизменном виде с выдыхаемым воздухом и до 10% с мочой. Продукты окисления выделяются через почки. Максимум выделения муравьиной кислоты отмечается через 2 суток после отравления метанолом.
Смертельная доза метанола варьирует в больших пределах (от 30 до 200 мл). Известны благоприятные исходы при отравлении 500 мл метанола. ПДК паров метанола в воздухе рабочей зоны 5 м г/м3.
Токсическое действие метанола зависит от:
-индивидуальной чувствительности организма к яду;
-количества выпитого яда;
-состояния нервной системы;
-степени наполнения желудка;
-наличия или отсутствия рвоты.
Метанол встречается при сухой перегонке дерева (древесный спирт); входит в состав растворителей, мебельной политуры; используется для денатурирования винного спирта, в химической промышленности (для получения формальдегида, для метилирования и т.д.), как антифриз, как моторное топливо (в смеси с бензином)
и т.д.
При окислении дает сначала формальдегид, затем муравьиную и, наконец, угольную кислоту. Часть муравьиной кислоты подвергается гидролизу до двуоксида углерода и воды.
сн 2 он
Этиленгликоль | -прозрачная маслянистая жидкость, без
СН2 ОН запаха, сладкая на вкус, обладает жгучим, раздражающим действием, не имеет цвета и запаха. Температура кипения 194-197°С, замерзания -40°С; удельный вес-1,114 – 1,116. Плотность пара 2,2. Не летуч, не воспламеняется, хорошо растворяется в воде, плохо в органических растворителях. При взаимодействии со щелочью легко окисляется и переходит в щавелевую кислоту.
Он широко применяется для получения взрывчатых веществ (вместо глицерина), для изготовления лекарственных препаратов, в табачной и текстильной промышленности, входит в состав некоторых тормозных жидкостей, используется как растворитель красок и т.д.
Отравления этиленгликолем довольно часты, так как он похож на спирт и может быть ошибочно принят внутрь, что может привести к печальным последствиям ввиду его чрезвычайной токсичности.
Единственным путем поступления его в организм является ЖКТ.
На поражающее действие влияют те же факторы, что и при действии метанола.
По статистическим данным, при употреблении:
-50 мл этиленгликоля развивается отравление легкой степени;
-100 мл – средней степени тяжести;
-150-200 мл – тяжелой степени;
-200-600 мл – смертельное отравление.
По данным других авторов (С.Я.Арбузов,1960.) смертельной дозой для человека является 50-150 мл.
Смертность при поражении этиленгликолем очень высока и составляет 62% всех случаев отравления этим ядом.
1,2-Дихлорэтан (ДХЭ) (симметричный дихлорэтан, хлористый этилен, этилен(ди)хлорид). CH2CI
Формула: | -бесцветная жидкость с запахом
CH2CI спирта или хлороформа.
Температура кипения 83,7 С. Удельный вес 1,2569. Плотность пара 3,42. Весьма стоек по отношению к воде, кислотам и щелочам. При температуре красного каления распадается на НСI и хлористый винил. В присутствии влаги и воздуха коррозирует металлы.
Применяется в различных экстракционных процессах, для приготовления дегазирующих растворов дихлорамина и гексахлормеламина, для обработки кожи перед дублением, для извлечения жира из шерсти, алколоидов из растительного сырья, для различных видов химической чистки и т.д. Служит исходным материалом синтеза этиленгликоля, эфиров гликоля, этилендиамина и др.аминов, хлористого винила и т.д.
Предельно допустимое содержание паров ДХЭ в воздухе рабочей зоны составляет 1´ 10 - 2 г/м3. Особенно опасно употребление внутрь, при котором доза 20-100 мл является смертельной.
1,1-Дихлорэтан (несимметричный дихлорэтан, хлористый этилиден, этилен(ди)хлорид). CH3
Формула: | - ввиду его малотоксичности рас-
CHCI2 сматриваться на данном занятии не будет.
Трихлорэтилен (трихлорэтен). Формула: СНСI=ССIз. Бесцветная жидкость слабоароматического запаха, напоминающего хлороформ, не растворимая в воде, но смешивающаяся с большинством органических растворителей. Температура кипения 88°С. Удельный вес (15°) -1,47. Плотность паров 4,56. Летучий при обычной температуре, малоустойчивый на воздействие воздуха и света, распадается в тепле, образуя соляную кислоту, двуокись углерода, фосген и дихлорметан.
Применяется в качестве растворителя для смол, пеков, реже ацетил- и нитроклетчатки, каучука, для экстрагирования жиров, восков и парафина, для очистки металлических деталей и изделий, особенно перед лакировкой, гальванической обработкой и т.д., для чистки тканей, одежды, для борьбы с паразитами, для консервирования яиц, для чистки фотопластинок, пленок, типографских станков, при газоочистке – как растворитель серы и фосфора и т.д.
Пути поступления в организм: ингаляционный, алиментарный, кожно-резорбтивный; выделяется через легкие и с мочой.
Предельно допустимая концентрация 300мг/м3, а средняя 200 мг/м3
2.МЕХАНИЗМ ТОКСИЧЕСКОГО ДЕЙСТВИЯ И ПАТОГЕНЕЗ ИНТОКСИКАЦИИ.
Метиловый спирт, после поглощения, в основном скапливается в ЖКТ и почках, наименьшее количество -в мозге, мышцах и жировой ткани.
Биотрансформация метанола и этилового спирта протекает в одних и тех же ферментных системах. С помощью аденозиндегидрогенаэы (АДГ) метиловый спирт окисляется в формальдегид, при участии алкогольной дегидрогеназы (АлДГ) формальдегид превращается в муравьиную кислоту, которая затем разлагается до конечных продуктов -углекислого газа и воды. Цикл окисления метанола завершается в течение 7-8 дней.
 -2Н / н +0 / Н
-2Н / н +0 / Н
СНзОН——————>С=0 ————————> С=0
АДГ \ Н АлДГ \ ОН
формаль- муравьиная
дегид кислота
Тканевая гипоксия развивается уже в первые часы интоксикации в результате действия целой молекулы метанола. Метанол ингибирует гликолиз, затрудняет транспорт электронов и протонов по цепи дыхательных ферментов на уровне никотинамидадениндинуклеотида (НАД). В итоге в тканях снижается содержание макроэргов, повышается количество недоокисленных продуктов -молочной кислоты и др.
По мере превращения метанола в муравьиную кислоту и накопления ее в крови и тканях еще больше усиливается ацидоз и сильнее угнетается процесс тканевого дыхания. Последнее связано со специфическим действием муравьиной кислоты на процессы энергообразования в тканях. Муравьиная кислота угнетает активность митохондриальных ферментов: сукцинат-цитохром-С-редуктазы, глутаман-щавелевокислой трансаминазы, малатдегидрогеназы. Вследствие этого нарушаются основные звенья клеточного обмена, что сопровождается в тяжелых случаях гибелью клеток.
Последствия этих эффектов потенциируются состоянием ацидоза, прогрессирующего по мере углубления тканевой гипоксии, накопления муравьиной кислоты. В итоге развиваются тяжелые морфологические изменения в тканях мозга, сетчатки и др.
Таким образом, тканевая гипоксия и снижение рН внутренней среды, развивающиеся в результате действия целой молекулы метанола и его метаболита – муравьиной кислоты, приводят к формированию тяжелейших нарушений в ЦНС и органе зрения. Не исключено, что важное значение для развития интоксикации имеет цитотоксическое действие формальдегида. Некоторые авторы причиной поражения зрительного нерва считают формальдегид.
Этиленгликоль. Механизм токсического действия связан с образованием в результате его метаболизма альдегидов и органических кислот. Эти вещества вызывают метаболический ацидоз, угнетение тканевого дыхания и образование нерастворимых оксалатов, которые в свою очередь являются причиной поражения мозга, почек, печени и др.
Пути формирования ацидоза и угнетения тканевого дыхания аналогичны разобранным при рассмотрении токсикологии метилового спирта. Однако, в отличии от метанола сам этиленгликоль слабо ингибирует тканевое дыхание, поэтому снижение содержания АТФ и формирование ацидоза в еще большей степени связаны с действием его метаболитов: гликоальдегида, глиоксалевой кислоты, гликолата и др.

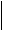 СНзОН СНО СНО СООН
СНзОН СНО СНО СООН
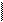
 ————> ———————> ———>
————> ———————> ———>
СН2ОН СНО СООН СООН
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 628; Нарушение авторских прав?; Мы поможем в написании вашей работы!