
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Факторы, влияющие на свойства вещества
|
|
|
|
Размерные классы частиц
Классификация вещественных объектов
Нанокомпозиционные материалы на основе полимерных матриц находят все большее применение в современном машиностроении. Служебные характеристики нанокомпозитов зависят не только от содержания низкоразмерного модификатора, но и от особенностей его зарядового состояния, определяющего активность в процессах адсорбционного взаимодействия.
К числу наиболее распространенных низкоразмерных модификаторов полимерных, олигомерных, керамических и металлических матриц относят порошки металлов, их оксидов, карбидов, нитридов, керамики, слоистых минералов, углеродсодержащие продукты детонационного синтеза УДА, УДАГ [4, 6, 14, 15, 19]. Установлены общие закономерности модифицирующего действия наночастиц различного состава и технологии получения, основанные на изменении кинетики адсорбционного взаимодействия полимерных макромолекул с активными центрами поверхностного слоя и формировании упорядоченной структуры граничного слоя под действием электрических полей наполнителя.
Анализ исследований в области создания функциональных полимерных нанокомпозитов свидетельствует об отсутствии единой точки зрения на влияние размеров и формы наночастиц на эффективность их модифицирующего действия. Для более строгого обоснования наноразмерности частиц модификатора потребовалось проведение теоретических исследований, объясняющих влияние размерных факторов на свойства вещества и позволяющих установить размер частиц 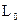 , ниже которого вещество начинает приобретать свойства, отличные от тех, которые характеризуют вещество в большом объеме. При размерах частиц
, ниже которого вещество начинает приобретать свойства, отличные от тех, которые характеризуют вещество в большом объеме. При размерах частиц 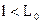 вещество переходит в наносостояние, так как
вещество переходит в наносостояние, так как 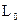 соответствует размерам, меньшим 100 нм [19, 26, 28].
соответствует размерам, меньшим 100 нм [19, 26, 28].
Рассмотрим классификацию частиц вещества по их крупности, не затрагивая механизмы межатомных и межчастичных взаимодействий.
Все вещества, которые человек использует в различных видах деятельности, делятся на естественные, то есть истинно природные, искусственные, то есть созданные человеком по природным аналогам, и синтетические, то есть не встречающиеся в природе, а созданные человеком для решения отдельных технических, бытовых, лечебных, исследовательских и других задач. Вещества являются атомно-молекулярными системами и откликаются на внешнее воздействие соответствующим образом, но всегда так, чтобы это воздействие ослабить. Если, например, в веществе создать температурные градиенты, то есть вдоль какого-то направления r будет наблюдаться изменение температуры ΔΤ (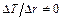 ), то объект будет выравнивать эту температуру, что приведет к возникновению теплового потока. Если материальный объект подвергнуть деформированию, то возникающие в нем напряжения создадут условия для формирования в нем таких сил, которые будут препятствовать силам деформирования. Этих примеров можно привести достаточно много. Таким образом, в общем случае можно говорить об откликах объектов любой природы на соответствующее внешнее воздействие. Эти отклики изучают, их численные парамтеры характеристик заносят в таблицы и называют «свойствами» материалов. Следовательно, принцип Ле-Шателье – Брауна: «Любая система отвечает на внешнее воздействие так, чтобы это воздействие максимально ослабить» проявляется в любых материалах, процессах и состояниях.
), то объект будет выравнивать эту температуру, что приведет к возникновению теплового потока. Если материальный объект подвергнуть деформированию, то возникающие в нем напряжения создадут условия для формирования в нем таких сил, которые будут препятствовать силам деформирования. Этих примеров можно привести достаточно много. Таким образом, в общем случае можно говорить об откликах объектов любой природы на соответствующее внешнее воздействие. Эти отклики изучают, их численные парамтеры характеристик заносят в таблицы и называют «свойствами» материалов. Следовательно, принцип Ле-Шателье – Брауна: «Любая система отвечает на внешнее воздействие так, чтобы это воздействие максимально ослабить» проявляется в любых материалах, процессах и состояниях.
Когда в общем случае говорят о свойствах вещества, то, как правило, размеры образца этого вещества не учитывают. Например, рассмотрим электропроводность (теплопроводность, упругость и т. д.) металлов. В справочных таблицах приведены значения параметров характеристик этого свойства без указания геометрических размеров образца, то есть a priori предполагают, что размеры образцов на эти свойства не влияют. Опыты показывают, что такое предположение действительно выполняется для широкого интервала размеров, но для очень маленьких (менее 0,1 мкм) частичек и у тонких пленок характеристики свойств могут существенно отличаться от объемных. Простейший пример – непрозрачный в макрообразце металл в пленочном состоянии пропускает свет.
В технике, в быту человек обычно имеет дело с крупными телами. Считают, что мелкие объекты в практике играют менее заметную роль. Развитие нанотехнологий, то есть технологий с использованием наноразмерных объектов (1 нм=10-9 м), заставило обратить внимание на изучение их свойств. Появился новый раздел научных исследований – нанофизика. В то же время мельчайшие системы играют громадную роль в жизнедеятельности организмов. Например, у человека при дыхании происходит поглощение кислорода в альвеолах легких, представляющих собой мельчайшие пузырьки воздуха, окруженные тончайшей пленкой, которую пронизывают капилляры. Общая площадь поверхности альвеол приближается к 100 м2, а их число измеряется сотнями миллионов. Кислород, попадая в кровь, связывается эритроцитами, число которых в теле человека превышает 25 триллионов. Диаметр эритроцита человека составляет 7-8 мкм. Для сравнения, у слона этот размер составляет 9 мкм, у кабарги – 2 мкм, у лягушки до 30 мкм. Громадную роль в нашей жизни играют биологические мельчайшие объекты – микроорганизмы (микробы и вирусы). Из своей жизненной практики мы знаем, что защититься от действия малых частиц, которое может быть не просто негативным, а разрушительным, гораздо труднее, чем от влияния крупных.
Существенное влияние на жизнедеятельность нашего организма оказывает пленочное состояние вещества. Например, долгое время считали, что вода в нашем организме выполняет функцию среды, в которой протекают биохимические реакции. Однако во второй половине XX века было установлено, что сама вода является активным участником процессов в живых организмах: она, к тому же, в этом случае обладает характеристиками свойств, отличными от характеристик объемной воды. Объемная вода при 0°С замерзает, и при этом увеличивается ее объем. Следовательно, любое дерево после зимних морозов должно погибнуть, так как в его стволе есть вода, которая, замерзая (в стволах деревьев нет источников тепла), должна разорвать капилляры и клетки дерева. Этого не происходит, потому что капиллярная и тонкопленочная вода обладают свойствами, отличными от свойств объемной воды. Такая вода, при понижении температуры увеличивает вязкость и не замерзает даже при ‑40 °С. Она, как говорят, «застекловывается», что не приводит к увеличению объема. В капиллярах и тонких пленках молекулы воды лишаются той подвижности, которая свойственна молекулам в объемной воде. Неудивительно, что пленочная вода характеризуется такой характеристикой, как сдвиговая упругость. Пленочная вода намного слабее реагирует на действие электрического поля, и ее теплопроводность может превосходить эту характеристику для объемной воды в 70 раз [19–21].
Каждая клетка нашего организма омывается жидкой субстанцией на основе пленочной воды. Если клетку моделировать шаром, то при радиусе d=4000 Å=4∙10-7 м ее поверхность равна  S≈5∙10-13 м2. Количество клеток в нашем организме N=1018. Следовательно, общая площадь поверхности всех клеток Ρ= 5∙105 м2=0,5 км2. В 70-ти килограммовом человеке воды примерно 50 л, значит толщина пленки на поверхности каждой клетки равна в среднем 10-7 м, то есть она включает не более 500 мономолекулярных водных слоев [21].
S≈5∙10-13 м2. Количество клеток в нашем организме N=1018. Следовательно, общая площадь поверхности всех клеток Ρ= 5∙105 м2=0,5 км2. В 70-ти килограммовом человеке воды примерно 50 л, значит толщина пленки на поверхности каждой клетки равна в среднем 10-7 м, то есть она включает не более 500 мономолекулярных водных слоев [21].
Биофизики, биохимики, физиологи и врачи в последние годы рассматривают гипотезу о том, что вода в живых организмах является не просто средой, необходимой для осуществления различных биохимических реакций и процессов, но и сама, находясь в особом состоянии, является таким же фундаментальным элементом жизненных процессов, как дезоксирибонуклеиновая кислота (ДНК), белки, липиды и др. Эти примеры, а к ним можно добавить и другие, показывают, что мир мелкодисперсных частиц и тонких пленок (по современной терминологии «наночастиц» и «нанопленок») играет громадную роль в процессах существования различных форм жизни на Земле. Естественно, частицы влияют на природные процессы, а то, что при наноуровневых размерах вещества начинают менять параметры характеристик своих свойств по сравнению с объемными, находит все большее применение на практике. Это обстоятельство привело к появлению новых технических решений, получивших название нанотехнологий, а также к формированию нанофизики, как раздела физики поверхностного состояния, занимающегося изучением наноразмерных объектов.
Как крупные, так и мелкие частицы могут иметь различную форму, когда их линейный размер вдоль различных направлений может иметь значения, резко отличающиеся от размеров для других направлений. Если исключить эти варианты, то можно говорить о частицах, у которых величина поперечного размера (d) не зависит от направления.
При описании частиц с малыми размерами указывают либо их поперечный размер (d), либо число таких частиц в 1 метре. Величину D, равную
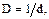 (1.1)
(1.1)
называют дисперсностью частицы. Так как размеры частиц обычно на порядки меньше метра, то удобнее использовать величину, называемую мерой дисперсности δ, равную
 (1.2)
(1.2)
В зависимости от меры дисперсности всю совокупность частиц можно разделить на несколько типов или классов дисперсности (табл. 1.1).
При размерах объекта r>1 м говорить об этом объекте как о частице просто нет смысла, это действительно громадный объект, поэтому в таблице номер класса у такого типа частиц нулевой. Так как размеры атомов лежат вблизи 1 Å=10-10 м, то размер частицы меньше 10-10 м невозможен. Таким образом, все частицы по своим размерам оказываются распределенными по 10 классам, каждый из которых находит определенное применение в различных областях деятельности человека, например, частицы классов 1, 2 применяют в строительстве, 3, 4 – как наполнители в бетонных системах, в дорожном строительстве, 5-7 – в медицинских препаратах, в различных пищевых добавках, в отраслях химической промышленности. Наибольший интерес в последние годы вызывают частицы 8-10 классов, которые относят к наноразмерным системам.
Таблица 1.1
Классификация частиц в зависимости от их размеров
| Номер класса частиц | Размер частиц, r [м] | Дисперсность D | Мера дисперс-ности δ | Название класса дисперсности |
| r>1 | D<1 | δ<0 | Гигантские | |
| 1>r>0,1 | 1<D<10 | 0<δ<1 | Очень крупные | |
| 10-1 >r>10-2 | 10<D<102 | 1<δ<2 | Сантиметровые | |
| 10-2>r>10-3 | 102<D<103 | 2<δ<3 | Миллиметровые | |
| 10-3>r>10-4 | 103<D<104 | 3<δ< 4 | Слабодиспергированные | |
| 10-4>r>10-5 | 104<D<105 | 4<δ<5 | Среднедиспергированные | |
| 10-5>r>10-6 | 105<D<106 | 5<δ<6 | Микронные | |
| 10-6>r>10-7 | 106<D<107 | 6<δ<7 | Высокодиспергированные | |
| 10-7>r>10-8 | 107<D<108 | 7<δ<8 | Очень мелкие | |
| 10-8>r>10-9 | 108<D<109 | 8<δ<9 | Наноразмерные | |
| 10-9>r>10-10 | 10-9<D<10-10 | 9<δ<10 | Предельно мелкие |
Очевидно, что реальные вещественные объекты, имеющие различную форму, по разным направлениям могут относиться к различным классам дисперсности. Например, проволока вдоль своей оси относится к классу 0, а по направлению в сечении плоскостью перпендикулярной оси, может относиться к классам 4÷6. Это же замечание относится к листовым и пленочным материалам.
В общем случае для частиц любой формы для указания их дисперсности можно использовать обозначения тремя числами m, n, p, где эти числа обозначают класс дисперсности вдоль трех перпендикулярных осей. Значения этих классов можно указывать в порядке возрастания номера класса дисперсности.
Известно, что на количественные параметры свойств веществ оказывает влияние достаточно большое число самых различных факторов, которые можно разделить по нескольким группам.
Влияние химического состава вещества не требует какого-то особого аргументирования. Очевидно, что, взяв вещества разного химического состава, мы получим материалы с совершенно разными значениями служебных характеристик, даже если эти вещества имеют отдельные близкие параметры. Например, элементы одной группы (С и Si или А1 и Sc и т.п.) имеют много общего в химических реакциях, но отличаются друг от друга по значениям параметров физических свойств. Некоторые из этих параметров могут быть достаточно близкими для веществ разного состава, например, электро- или теплопроводность многих металлов и сплавов, но всегда имеются параметры, которые существенно разнятся в зависимости от состава [22].
 |
Вещества могут иметь одинаковые структурные мотивы. В качестве примера рассмотрим структуру сфалерита (ZnS), приведенную на рис. 1.2. Если в решетке сфалерита атомы Zn и S заменить атомами углерода, то получим структуру алмаза. Если вместо атомов в сфалерите размещены молекулы воды, то это будет структура льда–1. Сфалеритовый тип структуры имеют многие полупроводниковые (с алмазоподобной структурой) кристаллы [23].
Рисунок 1.2– Структура кристалла сфалерита (ZnS)
Вторая группа включает один, но очень важный фактор - идеальная структурная модель («идеальный структурный мотив», по Н.В.Белову [23]). Речь идет о структуре вещества, описываемой идеализированной взаимоконфигурацией (взаимным расположением) образующих его атомов. Эта идеализированная схема строго соответствует определенной точечной и пространственной группам, если вещество кристалл, либо определенному типу взаиморасположения координационных полиэдров, молекул, радикалов, отдельных атомов. Если вещество некристаллическое, то и в этом случае вещества с одинаковым составом могут иметь разные параметры свойств, так как одни и те же атомы могут образовывать различные молекулы [23, 24].
Наиболее яркими примерами кристаллов с одинаковым химическим составом и различными свойствами являются алмаз и графит, серое и белое олово, полиморфные модификации железа, аллотропные разновидности серы и др.
Факторы первого и второго типа можно объединить, введя понятие «идеальная кристаллохимическая модель» для кристаллов и «структурно-химическая модель» для некристаллических веществ.
Третья группа факторов, влияющих на свойства веществ – это дефекты, которые являются любыми отклонениями состава или структуры данного конкретного образца («вещественного индивидуума» по терминологии академика Н.В. Белова) от идеальной кристаллохимической модели. Понятие дефекта (дефектности) в физике конденсированного состояния не имеет негативного смысла. Наоборот, дефектность – это возможность изменить свойства вещества в требуемом направлении. Например, введение примесей в диэлектрик может преобразовать его в полупроводник. Дефекты могут существенно изменить деформационно-прочностные характеристики, например, ковка или дробеструйная обработка упрочняет стальное изделие вследствие увеличения количества дефектов в поверхностном слое (явление «наклепа»).
Дефекты можно разделить на несколько типов по их размерности. Нольмерные или точечные дефекты затрагивают отдельные атомы. К таким дефектам относят смещения атомов от идеального положения в произвольную (межузельную) позицию (дефекты Френкеля), невхождение атома в его структурную позицию, то есть образование вакансии (дефекты Шоттки), дефекты замещения основного атома примесным, внедрение «чужого» атома в междоузлия (дефект внедрения) и т.п. [25].
Примеры таких дефектов приведены на рис. 1.3. Идеальный ионный кристалл, взятый для примера, приведен на рис. 1.3 (а). Рассматривается фрагмент плоской сетки с регулярным идеальным расположением ионов. На рис. 1.3 (б) приведена ионная сетка того же кристалла, но в ней часть ионов отсутствует, что может быть обусловлено самыми различными причинами. Если кристалл не имеет примесей, то для сохранения его электростатической нейтральности число вакансий в позициях положительных и отрицательных ионов должно быть одинаковым, то есть отношение числа анионов 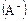 и катионов
и катионов  остается тем же, что и для идеального кристалла.
остается тем же, что и для идеального кристалла.
 а
а
|  б
б
|  в
в
|
Рисунок 1.3 – а – идеальный ионный кристалл; б - ионный кристалл с точечными дефектами Шотки (равные количества вакансий на местах положительных и отрицательных ионов); в – ионный кристалл с дефектами Френкеля
В данном примере  Это отношение сохраняется и в том случае, если отдельные катионы и (или) анионы смещаются от своих идеальных позиций, как это изображено на рис. 1.3 (в). Дефекты такого типа называются дефектами Френкеля. Заметим, что число сместившихся катионов и анионов не обязательно должно быть одинаковыми. Важно, чтобы выполнялся принцип электронейтральности кристалла в целом. Необходимо отметить, что появление вакансий и смещение атомов (в примере – ионов) затрагивает не одну ячейку. Там где есть эти точечные дефекты, кристаллическая ячейка искажается, но это искажение вызывает искажение соседних с ней ячеек, что иллюстрируется схемами искажений для некоторых точечных дефектов (рис. 1.4). Для точечных дефектов других типов, по сравнению с приведенными на примерами, картина искажений легко определима. Например, искажения при дефекте Шоттки будут аналогичными искажениям на рис. 1.4 (б). В молекулярных кристаллах, у которых молекулы неполярные при появлении дефекта замещения, когда внедрившимся объектом является ион, произойдет разворот дипольных молекул основной структуры, так как показано на рис. 1.4 (б). При этом, конечно, могут произойти и искажения структурных ячеек в окрестностях точечного дефекта. На рис. 1.4 (б) эти искажения не показаны. Как видно из приведенных примеров, потребуется довольно большое число, по крайней мере, десятки таких ячеек, в которых, по мере удаления от точечного дефекта, его влияние станет пренебрежительно малым. Следовательно, в кристалле возникает область с повышенной, по сравнению со средней для кристалла, внутренней энергией. Если такие области выходят на поверхность кристалла, то на ней возникают поверхностно активные центры, которые имеют отличные от других участков энергетические параметры и, следовательно, могут характеризоваться отличными от идеального кристалла параметрами свойств, как и от реального кристалла, где эти дефекты не проявляются.
Это отношение сохраняется и в том случае, если отдельные катионы и (или) анионы смещаются от своих идеальных позиций, как это изображено на рис. 1.3 (в). Дефекты такого типа называются дефектами Френкеля. Заметим, что число сместившихся катионов и анионов не обязательно должно быть одинаковыми. Важно, чтобы выполнялся принцип электронейтральности кристалла в целом. Необходимо отметить, что появление вакансий и смещение атомов (в примере – ионов) затрагивает не одну ячейку. Там где есть эти точечные дефекты, кристаллическая ячейка искажается, но это искажение вызывает искажение соседних с ней ячеек, что иллюстрируется схемами искажений для некоторых точечных дефектов (рис. 1.4). Для точечных дефектов других типов, по сравнению с приведенными на примерами, картина искажений легко определима. Например, искажения при дефекте Шоттки будут аналогичными искажениям на рис. 1.4 (б). В молекулярных кристаллах, у которых молекулы неполярные при появлении дефекта замещения, когда внедрившимся объектом является ион, произойдет разворот дипольных молекул основной структуры, так как показано на рис. 1.4 (б). При этом, конечно, могут произойти и искажения структурных ячеек в окрестностях точечного дефекта. На рис. 1.4 (б) эти искажения не показаны. Как видно из приведенных примеров, потребуется довольно большое число, по крайней мере, десятки таких ячеек, в которых, по мере удаления от точечного дефекта, его влияние станет пренебрежительно малым. Следовательно, в кристалле возникает область с повышенной, по сравнению со средней для кристалла, внутренней энергией. Если такие области выходят на поверхность кристалла, то на ней возникают поверхностно активные центры, которые имеют отличные от других участков энергетические параметры и, следовательно, могут характеризоваться отличными от идеального кристалла параметрами свойств, как и от реального кристалла, где эти дефекты не проявляются.
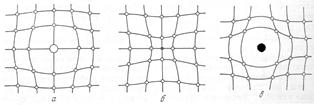
Рисунок 1.4 – Примеры искажений структуры при точечных дефектах: а – замещающий атом крупнее основного атома в структуре; б – замещающий атом мельче основного атома;
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 2453; Нарушение авторских прав?; Мы поможем в написании вашей работы!