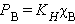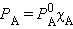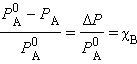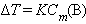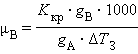КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Законы Рауля
|
|
|
|
Закон Генри.
Если растворенное вещество характеризуется большой упругостью пара по сравнению с упругостью пара растворителя (PB >> PA) и при этом оба компонента раствора химически инертны, то растворение такого газообразного вещества в жидкости подчиняется закону Генри: при постоянной температуре давление летучего (газообразного) компонента P B прямо пропорционально его мольной доле χB:
| (6.1) |
KH – константа Генри.
В табл. 6.1 приведены константы Генри некоторых газов для воды.
| ||||||||||||||
| Таблица 6.1. Константы Генри для воды при 298 K. |
Из уравнения (6.1) следует, что KH определяется выбором единиц давления и концентрации.
Если упругость пара растворенного вещества очень мала PB << PA, то его парциальным давлением можно пренебречь (нелетучий компонент), и тогда упругость пара над раствором будет зависеть только от парциального давления растворителя:
|
Это первый закон Рауля – парциальное давление над раствором прямо пропорционально мольной доле растворенного вещества. После подстановки χA = 1 – χB и несложных преобразований
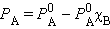
|
получаем
|
Относительное понижение упругости пара над раствором равно мольной доле растворенного вещества. Это закон Рауля для нелетучего растворенного компонента. Из этого закона можно вывести два следствия, которые в объединенном виде формируются как второй закон Рауля.
|
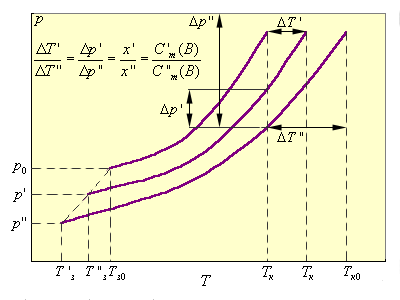
| Рисунок 6.2. Зависимость повышения температуры кипения ΔTкип и понижения температуры замерзания ΔTзам раствора от концентрации растворенного вещества. |
На рис. 6.2 приведены зависимости P(T) чистого растворителя и двух его растворов P'(T) и P''(T).
Выразим мольную долю 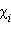 через моляльную концентрацию
через моляльную концентрацию 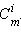 Для двухкомпонентного раствора
Для двухкомпонентного раствора 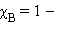
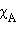 . При
. При 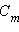 << 1 получим
<< 1 получим
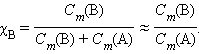
|
Из подобия треугольников следует
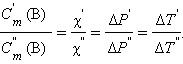
|
По определению, при  (B) = 1 моль∙
(B) = 1 моль∙  повышение температуры
повышение температуры 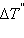 равно
равно 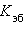 – эбулиоскопической константе для данного растворителя. Тогда повышение температуры кипения для данного раствора будет пропорционально его моляльной концентрации:
– эбулиоскопической константе для данного растворителя. Тогда повышение температуры кипения для данного раствора будет пропорционально его моляльной концентрации:
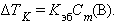
|
Проведя аналогичное исследование, касающееся понижения температуры замерзания раствора, получим
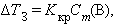
|
где Kкр – криоскопическая константа.
Второй закон Рауля – понижение температуры кипения и повышение температуры замерзания раствора прямо пропорционально моляльной концентрации раствора:
|
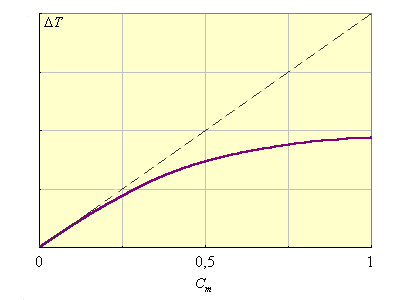
Kэб и Kкр являются экстраполяционными величинами от малых концентраций растворенного вещества, где выполняется этот закон, на Cm(B) = 1, где этот закон уже не действует (рис. 6.3). В табл. 6.2 приведены Kкр и Kэф для воды и бензола.
|
| Рисунок 6.3. Иллюстрация справедливости второго закона Рауля для разбавленных растворов и экстраполяционной природы Kкр и Kэб. |
| |||||||||
| Таблица 6.2. Криоскопические и эбулиоскопические константы для воды и бензола (град∙моль–1∙кг). |
Второй закон Рауля дает легко осуществимую экспериментально возможность определения молекулярных масс некоторых молекулярных соединений, неспособных к диссоциации в данном растворителе. Действительно, моляльная концентрация растворенного вещества может быть представлена в виде соотношения Cm = gB ∙ 1000 / μB ∙gA, где gA – вес растворителя, gB – вес растворенного вещества, μB – его молярная масса. Тогда из ΔT = Kкр · m получим молярную массу растворенного вещества:
|
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 499; Нарушение авторских прав?; Мы поможем в написании вашей работы!