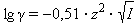КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Растворы сильных электролитов
|
|
|
|
Выполнить вопрос №23 из теста.
Определение индикатора.
Лабораторная работа №6.
Водородный показатель pH.
Для определения кислотно-основных свойств раствора пользуются водородным показателем pH. По определению, это отрицательный десятичный логарифм концентрации водородных ионов: pH = –lg [H+].
Цель:
1. Запомнить окраску индикатора: кислый, щелочной, нейтральный. Составить таблицу.
2. Осмыслить понятие «Водородный показатель рН» и освоить его расчет.

|
| Модель 6.7. Индикаторы. |
Очевидно, –lg [H+][OH–] = –lg 1 ∙ 10–14 дает pH + pOH = 14.
Тогда pH < 7 указывает на кислую среду, pH > 7 соответствует щелочной среде, pH = 7 – нейтральной среде.
Поскольку pH + pOH = 14, можно видеть, что pH может меняться от небольших отрицательных значений до величин, немного превышающих 14 (pH NaOH c C = 2 равен 14,3). На рис. 6.5 приведены pH некоторых бытовых растворов и пищевых продуктов.

|
| Рисунок 6.5. pH различных веществ и систем. |
Принципиальное отличие сильных электролитов от слабых состоит в том, что равновесие диссоциации сильных электролитов полностью смещено вправо:

|
а потому константа равновесия (диссоциации) оказывается величиной неопределенной. Снижение электропроводности при увеличении концентрации сильного электролита обусловлено электростатическим взаимодействием ионов.
Дебай и Хюккель, предложив модель, которая легла в основу теории сильных электролитов, постулировали:
1. Электролит полностью диссоциирует, но в сравнительно разбавленных растворах (C = 0,01 моль·л–1).
2. Каждый ион окружен оболочкой из ионов противоположного знака. В свою очередь, каждый из этих ионов сольватирован. Это окружение называется ионной атмосферой.
Очевидно, что при электростатическом взаимодействии ионов противоположных знаков необходимо учитывать влияние ионной атмосферы. При движении катиона в электростатическом поле ионная атмосфера деформируется; она сгущается перед ним и разрежается позади него. Эта асимметрия ионной атмосферы оказывает тем более тормозящее действие движению катиона, чем выше концентрация электролитов и чем больше заряд ионов. В этих системах само понятие концентрации становится неоднозначиным и должно заменяться активностью. Для бинарного одно-однозарядного электролита KatAn → Kat+ + An+ активности катиона (a +) и аниона (a –) соответственно равны
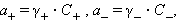
|
где C + и C – – аналитические концентрации соответственно катиона и аниона, γ+ и γ– – их коэффициенты активности.
Определить активности каждого иона в отдельности невозможно, поэтому для одно-однозарядных электролитов пользуются средними геометрическими значений активностей и коэффициентов активностей:
 
|
Коэффициент активности по Дебаю–Хюккелю зависит по крайней мере от температуры, диэлектрической проницаемости растворителя (ε) и ионной силы (I); последняя служит мерой интенсивности электрического поля, создаваемого ионами в растворе.
Для данного электролита ионная сила выражается уравнением Дебая–Хюккеля:
|
Ионная сила в свою очередь равна
|
Здесь C – аналитическая концентрация, z – заряд катиона или аниона. Для одно-однозарядного электролита ионная сила совпадает с концентрацией. Таким образом, NaCl и Na2SO4 при одинаковых концентрациях будут иметь разные ионные силы. Сопоставление свойств растворов сильных электролитов можно проводить только тогда, когда ионные силы одинаковы; даже небольшие примеси резко изменяют свойства электролита.
На рис. 6.6 сопоставляются вычисленные и экспериментальные значения lg γ± при различных ионных силах. Из него видно, что уравнение Дебая–Хюккеля выполняется только для разбавленных растворов.

|
Рисунок 6.6.
Зависимость 
|
Пунктирные прямые рассчитаны по уравнению Дебая–Хюккеля. Знание коэффициентов активностей позволяет оценить реальные свойства сильных электролитов.
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 505; Нарушение авторских прав?; Мы поможем в написании вашей работы!