
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Выполнить вопросы №25 из теста
|
|
|
|
Осмос.
Лабораторная работа №3.
Осмос.
Если система, разделенная мембраной, представляет собой растворы, в которых через мембрану способны проходить только молекулы растворителя, то свойства ее будут определяться разностью мольных долей (концентраций) растворителя по обе стороны мембраны.
Явление, связанное со способностью проходить через мембрану, в частности, только молекул растворителя, называется осмосом, а вызываемое им изменение давления по обе стороны мембраны – осмотическим давлением. Явление осмоса чрезвычайно разнообразно и во многом определяется природой мембраны и компонентов раствора.
Цели:
1. Изучить понятие «осмос».
2. Наблюдать явление в ходе лабораторной работы.
3. Вычислить осмотическое давление (Р).
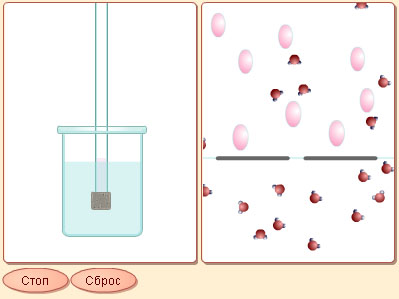
|
| Модель 6.3. Осмос. Эта модель демонстрирует явление осмоса как в мелком, так и в крупном масштабе. Вы видите неподвижные стакан и трубку с водой за пористой перегородкой в левом окне, а в правом окне, в крупном масштабе – движение молекул воды в стакане. Затем трубка начинает опускаться в стакан, в результате чего молекулы воды из стакана могут переходить в трубку сквозь пористую перегородку. Однако их обратное проникновение затруднено наличием растворенного вещества (схематически показанного в модели розовыми образованиями оваль ной формы), не проникающего через пористую перегородку. В результате молекулы воды реже проходят в обратном, нежели в прямом направлении. Это и создает суммарный поток молекул воды, направленный в трубку, и уровень воды в ней начинает повышаться. Он повышается до тех пор, пока избыточное давление воды в трубке не уравняет потоки молекул в ту и в другую сторону. Это избыточное давление и называется осмотическим давлением. |
Представим, что сосуд с двумя горлами для залива раствора разделен мембраной M (рис. 6.4). В каждую часть сосуда зальем растворы, отличающиеся только концентрацией. Поскольку мольные доли растворителя по обе стороны мембраны не совпадают, то стремление их к выравниванию приведет к переходу части растворителя в ту часть сосуда, где концентрация растворенного вещества больше. Увеличение количества растворителя эквивалентно возрастанию давления, и если мембрана способна к деформации, она изогнется в сторону с меньшей концентрацией растворенного вещества (рис. 6.4а).
Если мембрана жесткая, то в отсеке с большей концентрацией количество растворителя будет возрастать до тех пор, пока гидростатическое давление h (рис. 6.4б) не станет равным осмотическому давлению и не прекратит осмос.
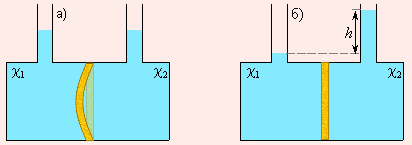
|
| Рисунок 6.4. Схема разности осмотических давлений при χ1 < χ2 при эластичной (а) и жесткой (б) мембранах. |
Осмотическое давление π – внутреннее давление растворенного вещества, численно равное тому внешнему давлению, которое нужно приложить, чтобы прекратить осмос; оно зависит от температуры и концентрации.
Эту зависимость Вант-Гофф уподобил поведению идеального газа:

|
По Вант-Гоффу осмотическое давление раствора численно равно тому газовому давлению, которое имело бы растворенное вещество, будучи переведенным в газообразное состояние в том же объеме и при той же температуре. Поскольку объем (разбавление) обратно пропорционален концентрации, то закон Вант-Гоффа можно записать в виде
|
Так как объем одного моля газообразного вещества при нормальных условиях равен 22,4 литра, то осмотическое давление раствора, содержащего 1 моль вещества, равно 22,4 атм.
Измерение осмотического давления раствора используется для определения молекулярных масс даже разбавленных растворов, что позволяет оценивать молекулярные массы растворимых высокомолекулярных соединений, в частности, биополимеров. Заменив C(B) в формуле Вант-Гоффа соотношением (m(B) ∙ 1000 / μ(B) ∙ V), получим уравнение, позволяющее вычислять молекулярные массы растворенных веществ:

|
m(B) – масса растворенного вещества, V – объем раствора.
Если растворы характеризуются одинаковыми осмотическими давлениями, то по Вант-Гоффу такие растворы называются изотоническими. Независимо от природы растворенного вещества, изотоничность является следствием одинакового числа частиц в растворе.
Поскольку при растворении реальное число частиц может отличаться от числа растворенных молекул, Вант-Гофф ввел понятие изотонического коэффициента i. По определению это отношение числа всех частиц к числу растворенных молекул:
| (6.1) |
В бензольном растворе уксусной кислоты i < 1, ибо в этом растворе число частиц меньше числа молекул, в результате реакции ассоциации в соответствие с уравнением
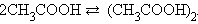
|
Если же в растворе преобладает не ассоциативный, а диссоциативный или ионизационный механизмы взаимодействия, то i > 1. Так, в водном растворе уксусная кислота диссоциирует CH3COOH = CH3COO– + H+, и число частиц становится больше числа молекул.

|
| Модель 6.4. Полунепроницаемая мембрана. |
Моделируется процесс возникновения осмотического давления в системе с полупроницаемой перегородкой. Перегородка, разделяющая сосуд на две половины, проницаема для одного из газов и непроницаема для другого. Модель позволяет продемонстрировать закон Дальтона для смеси газов.
Если в сосуде находится смесь газов, то каждый из них вносит свой вклад в общее давление. Парциальным давлением называют давление одного из газов при условии, что все остальные удалены из сосуда. Экспериментально установленный закон Дальтона утверждает: давление в смеси химически невзаимодействующих газов равно сумме их парциальных давлений:
| P = P1 + P2 +... |
При этом парциальное давление каждого из газов подчиняется в случае достаточно разреженных газов уравнению состояния идеального газа:
| P1V = (m1/μ1)RT; P2V = (m2/μ2)RT;..., |
где V – объем смеси, T – абсолютная температура, m1, m2,... – массы различных газов в смеси, μ1, μ2,...– их молярные массы.
Примером газовой смеси является воздух, состоящий из азота, кислорода, углекислого газа и других газов.
Иллюстрацией закона Дальтона может служить процесс диффузии газа через полупроницаемую перегородку (мембрану). Пусть в начальный момент два разных газа занимают две половины сосуда, разделенные полупроницаемой мембраной. Температуры обоих газов и их начальные давления одинаковы. Мембрана полностью непроницаема для одного из газов и частично прозрачна для другого. В процессе диффузии газа через полупроницаемую перегородку давление в одной половине сосуда возрастает в соответствии с законом Дальтона, а в другой – падает. Это явление носит название осмоса.
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 437; Нарушение авторских прав?; Мы поможем в написании вашей работы!

