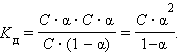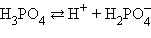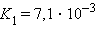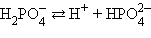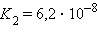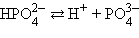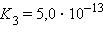КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Выполнить вопросы №20, №21 из теста
|
|
|
|
Реакции нейтрализации (модель 6.5). Гидролиз.
Лабораторная работа №5.
Цели:
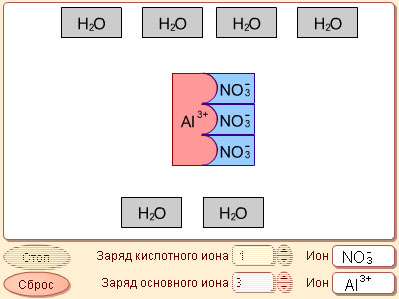
1. Вспомнить какие реакции называют реакциями нейтрализации.
2. Экспериментально провести 4 типа реакции (на модели 6.5) и записать молекулярное, полное и сокращенное ионные уравнения.
3. Отметить окраску и объяснить её в каждом опыте.
Важнейшей характеристикой слабых электролитов служит константа диссоциации.
Рассмотрим равновесную реакцию диссоциации слабого электролита HAn:
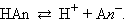
|
Константа равновесия Kc этой реакции и есть Kд:
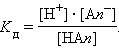
|
Если выразить равновесные концентрации через концентрацию слабого электролита C и его степень диссоциации α, то получим
|
Это соотношение называют законом разбавления Оствальда. Для очень слабых электролитов при α << 1 это уравнение упрощается:
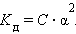
|
Тогда
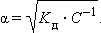
|
Это позволяет заключить, что при бесконечном разбавлении степень диссоциации α стремится к единице.
Рассмотрим диссоциацию N моль электролита, диссоциирующего на n ионов. Тогда (6.1) можно записать в виде
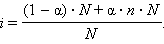
|
Решая его относительно α, получим
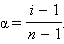
|
Определив экспериментально изотонический коэффициент, можно найти степень диссоциации α в условиях эксперимента.
|
| Модель 6.6. Реакции кислот и оснований. Эта модель схематически демонстрирует детали реакции нейтрализации. Вы увидите, как от кислоты отщепляется водород, образуя вместе с молекулой воды положительный ион гидроксония. Затем этот ион взаимодействует с гидроксильной группой, отщепленной от основания, в результате чего образуются две молекулы воды. Обратите внимание, что растворимая в воде соль в растворе существует в виде отдельных гидратированных кислых и основных ионов. Если же воду выпарить, то соль останется в моно- или поликристаллическом виде. Как правило, в состав кристалла, кроме собственно соли, будут входить еще и молекулы воды. Отличия реального процесса от схематической иллюстрации в модели обусловлено большим количеством молекул кислоты, щелочи и воды, принимающих участие в реальной реакции. |
Кислоты и основания диссоциируют ступенчато. Каждая ступень диссоциации характеризуется своей константой. Так, трехосновная ортофосфорная кислота H3PO4 диссоциирует следующим образом
| ||||||||||||
| Таблица 6.3. |
Важное значение имеет диссоциация воды, поскольку, являясь слабым электролитом и обычным растворителем, она участвует в кислотно-основном равновесии растворенных в ней электролитов.
Вода диссоциирует на ионы:

|
ее константа при 298 K равна
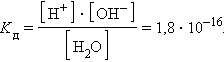
|
При столь малой константе диссоциации концентрация воды остается практически неизменной и равной
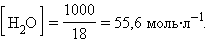
|
Отсюда произведение постоянных величин Kд∙[H2O] = [H+]∙[OH–] = const.
Численная величина произведения ионов, на которые диссоциирует вода, называемое ионным произведением воды Kв, равна
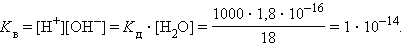
|
Таким образом, в пределах 15–25 °C ионное произведение воды Kв = 10–14.
Равенство [H+] и [OH–] соответствует нейтральной среде [H+] = [OH–] = 1 ∙ 10–7, при [H+] > 1 ∙ 10–7 – кислой, при [H+] < 1 ∙ 10–7 – щелочной.
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 437; Нарушение авторских прав?; Мы поможем в написании вашей работы!