
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Определение слабых, средних и сильных электролитов по электропроводности
|
|
|
|
Лабораторная работа №4.
Цели:
1. Ознакомиться с понятиями слабых и сильных электролитов. Вспомнить классификацию кислот и оснований.
2. Экспериментально определить сильные, средние и слабые электролиты. Записать их в3 колонки:
| Сильные: | Средние: | Слабые: |
3. Вспомнить характеристики слабых и сильных электролитов.
4. Запомнить, что при диссоциации сильные и средние электолиты распадаются на ионы, а слабые нет и в уравнениях записываются только их молекулы.
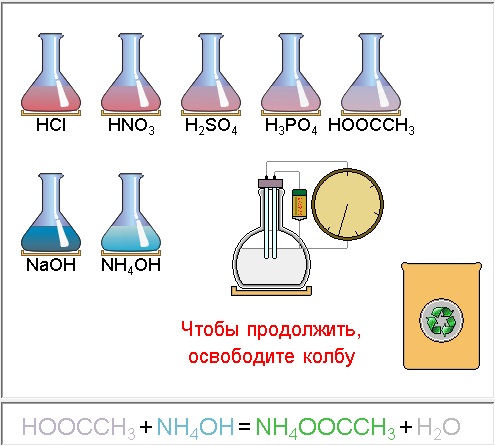
|
| Модель 6.5. Реакция нейтрализации и электропроводность. В этой модели демонстрируются некоторые свойства кислот и оснований, а также солей, получающихся в результате реакций между ними. В главном окне модели в верхнем ряду размещены колбы с кислотами, в нижнем – с основаниями. Как в эти колбы, так и в большую колбу для проведения реакций добавлен лакмус для определения кислотности раствора. Вы можете «налить» в колбу по одному веществу из верхнего и нижнего ряда и посмотреть, какой цвет примет индикатор. Для этого нужно перетащить соответствующую пробирку туда, где расположена колба. В большую колбу (как и в колбы с реагентами) также можно «поместить» прибор, измеряющий электрическую проводимость раствора. Степень отклонения стрелки от вертикального положения характеризует величину проводимости. В нижней части модели написано называние вещества, налитого в колбу. В случае, когда в колбе смешаны кислота и основание, приведено уравнение реакции, которая там происходит. Обратите внимание, что сильные кислоты (HCl, H2SO4, HNO3) и сильные основания (представленные в модели раствором NaOH) имеют большую величину проводимости, то есть являются сильными электролитами. Интересно, что все хорошо растворимые соли (а именно такие и представлены в нашей модели), даже образованные слабыми кислотами и слабыми основаниями, являются сильными электролитами. |
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 604; Нарушение авторских прав?; Мы поможем в написании вашей работы!