
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Краткие методические рекомендации
|
|
|
|
Приступая к выполнению опытов по изучению свойств буферных смесей необходимо иметь четкие теоретические понятия о составе буферных растворов и механизме их действия. Каждый опыт должен завершатся четко сформулированным выводом подтверждающим свойства буферных смесей. Там, где это возможно, необходимо написать соответствующие уравнения химических реакций или привести формулу, которая подтверждает ваш вывод.
Принадлежности для работы: Штатив для пробирок; семь пробирок две градуированные пробирки на 2 мл; 0,1 и 1 М растворы уксусной кислоты и ацетата натрия; 0,1 М растворы HCl и NaOH; физиологический раствор (0,9% р-р NaCl); универсальный индикатор с цветной шкалой для него; растворы метилового оранжевого и фенолфталеина.
Ход работы:
Опыт 1. Приготовление буферных смесей.
В семь одинаковых пробирок наливают при помощи градуированной пипетки или бюретки растворы 0,1 М растворы уксусной кислоты и ацетата натрия в объемах, указанных в таблице3
Таблица 3
| № пробирки | |||||||
| Объем кислоты, мл Объем раствора соли, мл Значение рН, найденное в опыте Значение рН вычисленное | 9,8 0,2 | 1,0 | 1,5 8,5 | 0,2 9,8 |
Размешав растворы в пробирках, добавляют к каждому из них по 3 капли универсального индикатора или опускают и смачивают универсальную индикаторную полоску и снова взбалтывают. Растворы или полоски универсальной бумаги окрашиваются в различные цвета. Сравнивая цвета полосок с цветной шкалой определяют примерное значение рН приготовленных буферных смесей. Точную концентрацию ионов водорода, а затем и рН рассчитывают по формулам:
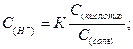

Величину К (константу диссоциации уксусной кислоты) принимают равной 1,85·10-5. Сравнивают значение рН найденное в опыте и рассчитанное по формулам. Делают вывод о точности определения рН с помощью универсального индикатора или индикаторной бумаги.
Опыт 2. Разбавление буферных смесей.
Приготавливают в трех колбах по 10 мл буферного раствора, взяв растворы кислоты и соли в тех состояниях, какие в пятой пробирке описанного выше опыта.
Раствор в первой колбе разбавляют дистиллированной водой в два раза, во второй - в три раза. Раствор в третьей колбе не разбавляют. Берут по 10 мл каждого раствора и прибавляют к каждому из них по 3 капли универсального индикатора. Окраска трех растворов будет одинакова, следовательно, рН от разбавления не изменяется.
Опыт 3. Действие кислот и щелочей.
В пробирку, содержащую раствор с наибольшим значением рН (из опыта «Приготовление буферных смесей»), приливают по каплям 0,1 М раствор хлороводородной кислоты. Цвет раствора практически не изменяется.
В пробирку с раствором, имеющим наименьшее значение рН, приливают по каплям 0,1 М раствор гидроксида. Цвет раствора практически не изменяется.
Опыт 4. Наливают в пробирку 12,5 мл 1 М раствора уксусной кислоты, 0,5 мл 1 М раствора ацетата натрия и 2-3 капли индикатора (метиловый оранжевый).
В другую пробирку наливают 13 мл физиологического раствора(0,9%) хлорида натрия и 2-3 капли того же индикатора, затем по каплям добавляют к данному раствору 0,01 М раствора хлороводородной кислоты до тех пор, пока характер окраски не станет таким же, как ацетатной смеси. После этого в каждую пробирку (с ацетатной смесью и физиологическим раствором) добавляют по 2-5 капель 0,1 М раствора гидроксида натрия и наблюдают изменение окраски буферной смеси и физиологического раствора.
Опыт 5. Буферная емкость.
В конической колбе приготавливают буферную смесь из 7 мл 0,1 М раствора CH3COOH и 3 мл 0,1 М раствора CH3COONa,прибавляют три капли универсального индикатора и при помощи цветной таблицы для универсального индикатора определяют значение рН приготовленной буферной смеси. Затем титруют буферный раствор 0,1 М раствором NaOH до едва заметного изменения окраски и записывают объем в миллилитрах NaOH, затраченных на титрование.
Опыт 6. Точно так же приготавливают другую буферную смесь на 3 мл 0,1 М раствора CH3COOH и 7 мл 0,1 М раствора CH3COONa.К смеси прибавляют три капли универсального индикатора и, как в первом случае, титруют тем же раствором NaOH до едва заметного изменения окраски. Записывают объем щелочи, затраченный на титрование.
Сравнивают результаты первого и второго титрования. Делают вывод о величине буферной емкости.
Опыт 7.Определение буферной емкости почвенной вытяжки. Важной характеристикой почв является их буферная емкость (буферность), о чем в некоторой степени можно судить по буферности почвенных вытяжек. В водных почвенных вытяжках содержатся карбонаты, фосфаты и частично белки(растворимая часть почв),наличие которых определяет буферность водных почвенных вытяжек.
Опыт 8. 20 г сухой почвы и 100 мл дистиллированной воды вносят в коническую колбу и встряхивают содержимое колбы в течение 3 минут. Затем фильтруют через складчатый фильтр и определяют рН фильтрата полоской универсальной лакмусовой бумаги. В две сухие плоскодонные колбы отмеривают по 20 мл почвенной вытяжки. В первую колбу добавляют две капли фенолфталеина и титруют 0,1 М раствором NaOH до появления слабо-малинового окрашивания. Во вторую колбочку с фильтратом добавляют 2-3 капли метилового оранжевого и титруют 0,1 М раствором HCl до появления слабо-розового окрашивания. Буферную емкость вычисляют по формуле:
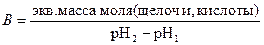
Для сравнения выполняют такой же опыт с безбуферным раствором, приготовленным из воды с добавлением к нему щелочи или кислоты до достижения такой же величины рН, как и у почвенной вытяжки.
Примечание. Рассчитать количество эквивалентных масс щелочи и кислоты, израсходованных на титрование 1 л. Буферного раствора можно по формуле:
 ; где
; где
Nщ -нормальность щелочи (или кислоты)
Vщ -объем раствора щелочи (или кислоты)израсходованный на титрование буферного раствора, в мл.(почвенной вытяжки)
Vбр- объем буферного раствора взятого для титрования(20 мл)
 считать равной единице
считать равной единице
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 908; Нарушение авторских прав?; Мы поможем в написании вашей работы!