
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Реальная константа
|
|
|
|
Концентрационная константа
При расчетах равновесий в реальных системах необходимо учитывать присутствие посторонних веществ и их влияние на поведение исходных веществ и продуктов изучаемой реакции. Это влияние может выразиться и в электростатическом взаимодействии ионов, и в химическом взаимодействии с образованием малодиссоциированных или малорастворимых продуктов. В обоих случаях наблюдается сдвиг равновесия изучаемой реакции. Концентрационная константа выражается через общие концентрации, а не активности исходных веществ и продуктов реакции. В том случае, когда посторонние вещества не вступают в конкурирующие химические реакции, концентрационную константу можно выразить через равновесные концентрации. Для удобства изучения часто концентрационную константу, выраженную через равновесные концентрации, называют реальной константой, а концентрационную константу, выраженную через общие концентрации, – условной константой.
Состояние равновесия характеризуется реальной (концентрационной) константой
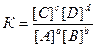
если отличия от идеальности обусловлены только электростатическими взаимодействиями А, В, С и D с посторонними ионами.
Активность и равновесная концентрация любого иона функционально связаны между собой простым соотношением. Например, для иона А
aA = γA[A]
Коэффициент пропорциональности γ, называемый коэффициентом активности, характеризует степень отклонения системы от идеальной из-за электростатических взаимодействий ионов, участвующих в изучаемой реакции, с посторонними (или собственными, если их концентрация высока) ионами. В идеальной системе aA = [А] и коэффициент активности равен единице. Это означает, что электростатические взаимодействия отсутствуют.
Величина коэффициента активности зависит от заряда и ионной силы, создаваемой всеми ионами в растворе:
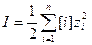 (1-2)
(1-2)
Здесь I – ионная сила; [i] – равновесная концентрация иона; zi — его заряд.
Коэффициенты активности индивидуальных ионов можно теоретически оценить по формулам Дебая - Хюккеля
 если I < 0.01 (1-3)
если I < 0.01 (1-3)
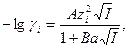 если I < 0.1 (1-4)
если I < 0.1 (1-4)
Здесь А и В – константы, зависящие от температуры и диэлектрической проницаемости растворителя (для воды при 20°С А = 0.5 и B = 0.3); а – расстояние максимального сближения ионов; эти величины обычно приводятся в справочных таблицах. Поскольку колебания в значениях а не слишком сказываются на конечном результате, рекомендуется брать постоянное значение a = 3 А. Следовательно,
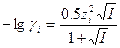 (1-5)
(1-5)
Коэффициент активности индивидуального иона нельзя измерить экспериментально, так как нельзя получить раствор, содержащий только положительные или только отрицательные ионы.
Для электролита AmBn экспериментально можно определить лишь средний коэффициент активности, который связан с коэффициентами активности индивидуальных ионов γA и γB соотношениями:
для бинарного электролита АВ 
для электролита типа AmBn 
Средний коэффициент активности можно рассчитать и теоретически, используя формулы Дебая - Хюккеля
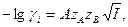 если I < 0.01
если I < 0.01
 если I < 0.1
если I < 0.1
Здесь а, А и В имеют те же значения, что и в формулах (1-3) и (1-4), поэтому
 (1-6)
(1-6)
При низких ионных силах (I < 0.1) величины средних коэффициентов активности, рассчитанные по формулам Дебая - Хюккеля и найденные экспериментально, удовлетворительно совпадают. Это говорит о правомочности использования в этих условиях формул (1-3) - (1-4) для расчета величин γ± и активности электролитов. Эти же формулы используются и для расчета коэффициентов активности индивидуальных ионов, хотя правильность таких расчетов нельзя проверить экспериментально.
Для более точного расчета коэффициентов активности предложено вводить в формулы Дебая - Хюккеля дополнительные члены. Например, уравнение Дэвиса позволяет вычислить коэффициенты активности электролитов и индивидуальных ионов для ионных сил 0.2 - 0.5 с погрешностью, не превышающей 10%. Уравнение Дэвиса для коэффициента активности индивидуального иона имеет вид:
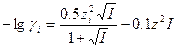 (1-7)
(1-7)
а для среднего коэффициента активности электролита АmВn:

Величины коэффициентов активности индивидуальных ионов при различных ионных силах и средние коэффициенты активности для растворов электролитов разной концентрации, рассчитанные по формулам Дебая - Хюккеля, приводятся в справочниках.
Зная коэффициенты активности, можно оценить активность иона или электролита в растворе. Для облегчения расчетов можно пользоваться следующими допущениями:
1. Коэффициенты активности ионов одинакового заряда независимо от радиуса ионов примерно равны. Поэтому в справочниках иногда приводятся усредненные величины коэффициентов активности для одно-, двух-, трех- и четырех-зарядных ионов.
2. Коэффициенты активности нейтральных частиц в разбавленных растворах электролитов полагают равными единице.
3. Очень разбавленные растворы электролитов, например насыщенный раствор малорастворимого электролита, можно считать идеальными.
ПРИМЕР 1. Рассчитайте активности ионов калия и сульфата в 0.10 М растворе сульфата калия.
Решение. Рассчитываем ионную силу, создаваемую ионами калия и сульфата

В справочнике находим, что при ионной силе 0.3
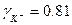 и
и 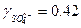
Поэтому в 0.10 М растворе сульфата калия
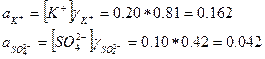
ПРИМЕР 2. Рассчитайте средний коэффициент активности для 0.10 М раствора гидроксида натрия и сравните его с экспериментально найденной величиной 0.764.
Решение. Рассчитываем ионную силу раствора:

По формуле Дебая - Хюккеля (1-6) находим γ±:
 , т.е. γ± = 0,757
, т.е. γ± = 0,757
Как видно, в данном случае рассчитанное и экспериментально найденное значения среднего коэффициента активности близки; различие составляет 0.8%.
Часто при расчетах сложных равновесий коэффициенты активности принимают равными единице. Такое допущение оправдано по ряду причин. Во-первых, величины коэффициентов активности, найденные по формулам Дебая - Хюккеля, могут в этих случаях оказаться очень далекими от истинных. Во-вторых, влияние химических факторов на равновесие гораздо больше, чем электростатических сил, поэтому пренебрежение последними при расчетах сложных равновесий не вносит ощутимую погрешность в результаты.
|
|
|
|
|
Дата добавления: 2015-01-03; Просмотров: 3555; Нарушение авторских прав?; Мы поможем в написании вашей работы!