
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основные положения теории кислот и оснований
|
|
|
|
Кислотно-основные реакции осуществляются за счет переноса протона от кислоты к основанию. Иначе говоря, кислота является донором, а основание акцептором протонов. Существуют также вещества, способные как отдавать, так и принимать протоны; они называются амфолитами. Кислотами могут быть молекулы (НС1, HCN), катионы (NH4+, Al(H2O)63+), анионы (НСО3-, Н2РО4-). Основания также могут быть нейтральными (NH3, (СН2)6N4, C5H5N), положительно заряженными (Аl(H2O)5ОН2+) и отрицательно заряженными (НРО42-, Н2РО4-, HS-). Амфолитами могут быть и заряженные (НРО42-, Н2РО4-, А1(Н2О)5ОН2+) и нейтральные (Н2О, NH3, C5H5OH, СН3СООН) частицы.
Вследствие малого размера протон обладает высокой поляризующей способностью и не может существовать в растворах в свободном виде. Поэтому реакцию диссоциации кислоты НА следует записывать так:
НА + SH ↔ SH2+ + А-
Здесь SH - растворитель, проявляющий свойства основания (акцептор протонов).
Аналогично можно записать и реакцию диссоциации основания В:
В + SH ↔ ВН+ + S-
Здесь растворитель проявляет свойства донора протонов, т. е. кислоты.
Диссоциация заряженной кислоты, например NH4^, описывается уравнением
NH4+ + SH ↔ NH3 + SH2+
Аналогично для заряженного основания, например СН3СОО-, следует записать
СН3СОО- + SH ↔ СН3СООН + S-
Нетрудно видеть, что если растворителем является вода, то эти реакции
СН3СОО- + Н2О ↔ СН3СООН + ОН-
в рамках теории Аррениуса называются реакциями гидролиза. Следовательно, гидролиз есть частный случай кислотно-основного равновесия и представляет собой реакцию диссоциации заряженных кислот и оснований в воде. Константу взаимодействия кислоты НА с растворителем
SH
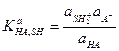
называют константой диссоциации кислоты НА (константой кислотности). В достаточно разбавленных растворах a(SH2+) - постоянная величина и практически не отличается от активности чистого растворителя, поэтому она включается в величину константы равновесия.
Аналогично константу равновесия реакции взаимодействия основания В с растворителем SH
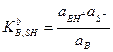
называют константой диссоциации основания (константой основности).
Легко видеть, что KaHA,SH и КbB,SH являются произведением двух гипотетических констант – «собственной» константы диссоциации кислоты НА (или основания В) и константы диссоциации растворителя SH по основному или кислотному типу соответственно:
KaHA,SH = KaHAKbSH
КbB,SH = KbBKaSH
Совершенно очевидно, что сила кислоты или основания в значительной степени зависит от кислотно-основных свойств растворителя. Чем более сильным основанием является растворитель, тем в большей степени диссоциируют в нем кислоты и тем в меньшей степени - основания. Наоборот, растворители с ярко выраженными кислотными свойствами усиливают диссоциацию оснований и подавляют диссоциацию кислот. Если при этом по «собственной» силе рассматриваемые кислоты (или основания) не слишком различаются, то растворитель с достаточно выраженными кислотными свойствами (протогенный) нивелирует эти различия у этих растворенных в нем оснований, но отчетливо дифференцирует кислоты. Наоборот, растворитель с хорошо выраженными основными свойствами (протофильный) нивелирует силу таких кислот и дифференцирует основания. В любом растворителе самой сильной кислотой является сольватированный протон - ион лиония, а самым сильным основанием - ион лиата. Так, в водном растворе самой сильной кислотой является ион гидроксония Н3О+ (Н9О4+), а самым сильным основанием - гидроксид-ион ОН-. В жидком аммиаке самая сильная кислота - ион аммония NH4+, а самое сильное основание -амид-ион NH2-.
Большинство растворителей способно проявлять и кислотные, и основные свойства, т. е. являются амфотерными (амфииротными). К ним относятся вода, низшие спирты, жидкий аммиак, безводные муравьиная и уксусная кислоты и т. п. Для амфотерных растворителей характерна реакция автопротолиза
SH + SH ↔ SH2+ + S-
константа равновесия которой
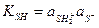
называется константой автопротолиза.
Несложно вывести очень полезное для расчетов уравнение, связывающее константу диссоциации кислоты НА, константу диссоциации сопряженного основания и константу автопротолиза растворителя SH:

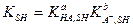 (2-1)
(2-1)
Это уравнение дает возможность, располагая одной из констант сопряженной кислотно-основной пары, которая есть в справочных таблицах, рассчитать другую, которой в справочниках может и не быть.
Надо помнить, что в таблицах значения КaHА и КbB даются применительно к определенному растворителю. Если индекс у константы опущен, то следует понимать, что растворителем является вода.
ПРИМЕР 1. Чему равна константа кислотности иона аммония?
Решение. Реакцию диссоциации кислоты NH4+ в воде
NH4+ + Н2О ↔ Н3О+ + NH3
характеризует
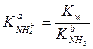
Значения Kw и Кb(NH3) равны 1.0·10-14 и 1.76·10-5 соответственно.
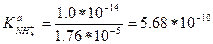
ПРИМЕР 2. Чему равна константа основности гидрокарбонат-иона?
Решение. Согласно уравнению реакции диссоциации
HCO3- + Н2О ↔ Н2СО3 + ОН-
сопряженной кислотой для иона НСО3- является угольная кислота. Поэтому по формуле (2-1):
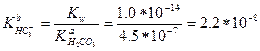
Диэлектрическая проницаемость растворителя также влияет на величину константы диссоциации кислоты и основания. Поскольку работа по разделению зарядов обратно пропорциональна диэлектрической проницаемости, то в полярных растворителях термины «диссоциация» и «ионизация» равнозначны. Это означает, что в растворителях с высокой диэлектрической проницаемостью (например, в воде) диссоциация проходит практически нацело и стадию образования ионной пары SH2+A- или BH+S- согласно уравнениям
НА + SH ↔ SH2+A- ↔ SH2+ + A-
или
В + SH ↔ BH+S- ↔ ВН+ + S-
можно не рассматривать. В растворителях с малой диэлектрической проницаемостью реакцией образования ионных пар пренебречь нельзя, и суммарная константа диссоциации является функцией константы ионизации (для стадии образования ионной пары) и константы диссоциации образовавшейся ионной пары. Поэтому с понижением диэлектрической проницаемости растворителя сила кислоты или основания уменьшается.
В меньшей степени диэлектрическая проницаемость сказывается на величинах констант диссоциации заряженных кислот и оснований. Это связано с тем, что не нужно совершать работу по разделению зарядов:
NH4+ + SH ↔ NH3SH2+ ↔ NH3 + SH2+
или
СН3СОО- + SH ↔ CH3COOHS- ↔ СН3СООН + S-
|
|
|
|
|
Дата добавления: 2015-01-03; Просмотров: 1429; Нарушение авторских прав?; Мы поможем в написании вашей работы!