
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Расчет рН растворов амфолитов
|
|
|
|
В водном растворе амфолита НА- устанавливаются равновесия:
НА- + Н2О ↔ Н3О+ + А2-
НА- + Н3О+ ↔ Н2А + Н2О
2Н2О ↔ Н3О+ + ОН-
Как видно, [Н3О+] ≠ [А2-], поскольку часть ионов водорода связана в Н2А. Поэтому (с учетом диссоциации воды)
[Н3О+] = [А2-] - [Н2А] + [ОН-]
Подстановка [Н2А], [А2-] и [ОН-], выраженных через Ка(Н2А), Ка(НА-) и Кw дает:

После преобразования получаем
 (2-9)
(2-9)
Применительно к конкретным случаям формулу (2-9) можно упростить.
1. Если Ка(Н2А) и Ка(НА-) не слишком близки, то можно полагать, что [Н2А] и [А2-] < [НА-] и [НА-] = С(НА-). Тогда
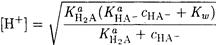 (2-10)
(2-10)
2. Если С(НА-) >> Ка(Н2А), то
 (2-11)
(2-11)
3. Если Ка(НА-) >> Kw, т.е. можно пренебречь [ОН-], то
 (2-12)
(2-12)
4. Если С(НА-) >> Ка(Н2А) и Ка(НА-) С(НА-) >> Kw, то
 (2-13)
(2-13)
ПРИМЕР 12. Рассчитайте рН 0.10 М раствора гидрокарбоната натрия.
Решение. В справочных таблицах находим

Поскольку С(НА-) >> Ка(Н2А) и Ка(НА-) С(НА-) >> Kw, то концентрацию ионов водорода в 0.10 М растворе гидрокарбоната натрия находим по формуле (2-13):
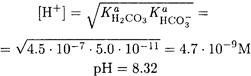
ПРИМЕР 13. Рассчитайте рН 0.010 М раствора гидросульфида натрия.
Решение. В растворе гидросульфида натрия устанавливаются равновесия:
HS- + Н2О ↔ Н3О+ + S2-
HS-+H3O+ ↔ H2S + H2O
Находим константы кислотности: Ка(H2S) = 1.0·10-7 и Ка(HS-) = 1.3·10-13. Итак, С(НS-) >> Ка(Н2S) = 1.0·10-7, но поскольку раствор разбавленный и Ка(НS-) С(НS-) < Kw, то диссоциацией воды пренебречь нельзя и расчет необходимо провести по формуле (2-11):

ПРИМЕР 14. Рассчитайте рН 5.0·10~3 М раствора дигидрофосфата натрия.
Решение. Равновесия в растворе дигидрофосфата натрия
Н2РО4- + Н2О ↔ НРО42- + Н3О+
Н2РО4- + Н3О ↔ Н2РО4 + Н2О
описываются константами кислотности 6.17·10-8 и 7.08·10-3 соответственно.
По условию задачи Ка( Н2РО4- ) >> Kw, но С(Н2РО4-) сопоставима Ка( Н3РО4 ), поэтому расчет концентрации ионов водорода следует провести по формуле (2-12):
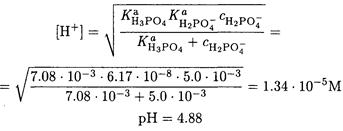
ПРИМЕР 15. Рассчитайте рН 0.10 М раствора цианида аммония.
Решение. В растворе цианида аммония содержится донор протонов ион аммония:
NH4+ + Н2О ↔ Н3О+ + NH3 (I)
и акцептор протонов цианид ион:
CN- + Н2О ↔ HCN + ОН- (II)
Следовательно, цианид аммония является амфолитом и для расчета рН можно использовать формулу (2-9). Так как концентрация иона аммония высока, то Ка(NH4+) С(NH4+) >> Kw и

Кислота NH4+ и основание CN- в растворе могут реагировать
NH4+ + CN- ↔ HCN + NH3 (III)
Константа равновесия этой реакции равна:
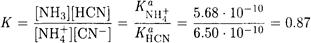
Величина константы указывает на то, что образующиеся в результате реакции (III) NH3 и HCN подавляют реакции (I) и (II). Следовательно, равновесные концентрации ионов аммония и цианида равны, так как цианид аммония содержит равные количества этих ионов. И, наконец,с учетом, что Ка(HCN) << [CN-] запишем:
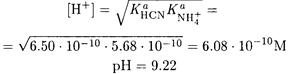
В растворах солей, состоящих из катион-кислоты и многоосновного основания, устанавливаются несколько равновесий. Следует пренебречь равновесием с наименьшим Ка. Например, в растворе NH4H2AsO4 величину рН определяет ион H2AsО4-, поскольку Ка(NH4+) << Ка( H3AsО4 ) и Ка(NH4+) << Ка( H2AsО4- ). Поэтому при расчете [Н3О+] используют формулу (2-13)
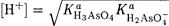
|
|
|
|
|
Дата добавления: 2015-01-03; Просмотров: 11603; Нарушение авторских прав?; Мы поможем в написании вашей работы!