
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Способы выражения констант устойчивости комплексных соединений
|
|
|
|
Реакцию комплексообразования в растворе можно определить как реакцию взаимодействия между ионом металла и лигандом. Образование комплексного соединения по этой реакции хорошо описывается с позиций электронной теории кислот и оснований Льюиса. Согласно этой теории при образовании координационной связи акцептор электронов (кислота Льюиса) взаимодействует с донором электронов (основанием Льюиса). Комплексное соединение как самостоятельная структурная единица способно существовать как в твердом виде, так и в растворе, хотя в растворе оно в той или иной степени диссоциирует.
Ионы металлов в растворах координируют молекулы растворителя, поэтому реакцию образования моноядерного комплексного соединения в растворе следует представлять как последовательное замещение молекул растворителя во внутренней координационной сфере на молекулы или ионы лиганда
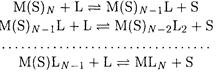
Реакция замещения молекул растворителя и других лигандов во внутренней координационной сфере может протекать с различной скоростью, в связи с этим различают лабильные (при высокой скорости замещения) и инертные (при малой скорости замещения) комплексные соединения.
Константа равновесия каждого из этих уравнений называется ступенчатой (или последовательной) константой устойчивости комплексного соединения. Как и в случае кислотно-основной реакции, константа устойчивости комплексного соединения зависит от природы растворителя, поскольку основной вклад в величину константы устойчивости вносит энтальпийный фактор, характеризующий разрыв связи M-S и образование связи M-L.
В аналитической практике растворителем обычно является вода. Если изучают разбавленные растворы, то можно считать, что активность воды в них близка к единице. Тогда для простоты при записи уравнений реакций координированные молекулы воды опускают и выражения для ступенчатых термодинамических констант устойчивости записывают следующим образом:
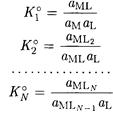
Заметим, что довольно часто константы устойчивости называют константами образования комплексных соединений.
Если ионная сила не равна нулю, равновесия в растворах комплексных соединений следует характеризовать реальными константами устойчивости, например
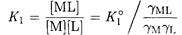
Очень часто в справочных таблицах приводятся именно реальные константы устойчивости, определенные при конкретном значении ионной силы.
Для расчетов удобны общие константы устойчивости β:
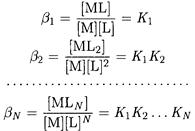
При необходимости учета конкурирующих реакций с участием комплексообразователя или лиганда равновесие в растворе комплексных соединений следует характеризовать условными константами устойчивости:
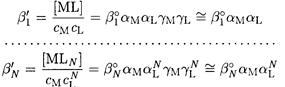
ПРИМЕР 1. Рассчитайте условную константу устойчивости комплексоната цинка при равновесной концентрации аммиака 0.01 М. Табличное значение константы устойчивости (I = 0.1) 3.2·1016.
Решение. В данном случае при вычислении условной константы устойчивости необходимо учесть протекание конкурирующих реакций с участием и аниона Y4-, и иона цинка:
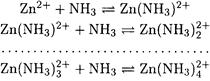
Находим рН 0.01 M раствора аммиака:
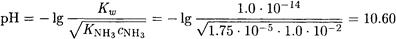
Для расчета a(Y4-)- при рН 10.60 можно воспользоваться упрощенной формулой (см. предыдущий пример):
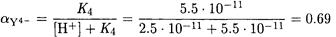
В 0.01 М растворе аммиака
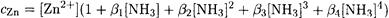
Отсюда, принимая [NH3] = 0.01 М, находим:
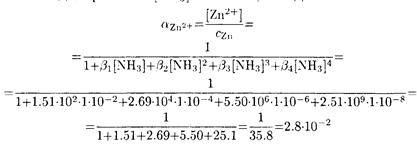
Условная константа устойчивости ZnY2- в 0.01 М растворе аммиака равна:
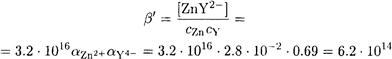
|
|
|
|
|
Дата добавления: 2015-01-03; Просмотров: 4429; Нарушение авторских прав?; Мы поможем в написании вашей работы!