
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Степень образования комплекса и расчет равновесных концентраций
|
|
|
|
Если известны константы устойчивости комплексных соединений и равновесные концентрации свободного лиганда, можно рассчитать степень образования комплексного соединения в растворе (молярную долю):
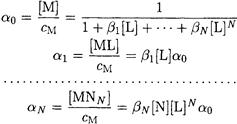
или в общем случае
 (3-2)
(3-2)
ПРИМЕР 3. Какой комплекс преобладает в растворе, содержащем 1·10-2 М кадмия(II) и 1 М аммиака?
Решение. В растворе, содержащем ионы кадмия и аммиак, устанавливаются следующие равновесия:


и далее но формуле (3-2)
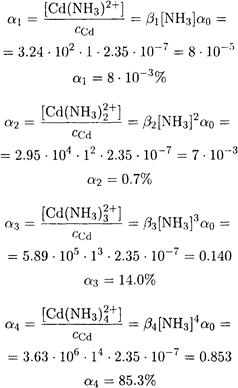
Расчет равновесных концентраций любых частиц в растворах комплексных соединений можно провести, используя уравнение материального баланса, а также функцию образования и степень образования. Часто ступенчатые константы устойчивости близки, и поэтому расчет равновесных концентраций бывает затруднительным. Для упрощения расчетов прибегают к ряду допущений:
1. При большом избытке лиганда можно полагать, что равновесная концентрация свободного лиганда равна его исходной концентрации.
2. При избытке металла можно полагать, что доминирующим является монолигандный комплекс.
3. В разбавленных растворах малоустойчивых комплексных соединений в отсутствие больших избытков лиганда маловероятно присоединение более чем одного-двух лигандов.
ПРИМЕР 4. Рассчитайте равновесную концентрацию Ag(NH3)+ в 0.01 М растворе нитрата серебра, содержащем 2 М аммиака.
Решение. Запишем уравнение материального баланса для раствора, содержащего серебро (I) и аммиак:

По таблицам находим:
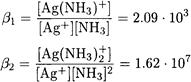
Выразив [Ag+] и [Ag(NH3)+] через константы устойчивости β1 и β2, преобразуем уравнение материального баланса следующим образом:

Итак, неизвестна только концентрация Ag(NH3)+:
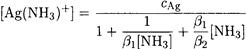
Поскольку C(NH3) >> С(Ag), то можно считать, что [NH3] = C(NH3) = 2 M.
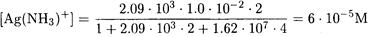
ПРИМЕР 5. Рассчитайте равновесные концентрации всех частиц в 0.010 М растворе хлорида кадмия (образованием гидроксокомплексов пренебречь).
Решение. В растворе хлорида кадмия существуют следующие равновесия:

Запишем уравнения материального баланса по кадмию и но хлорид-иону
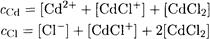
Поскольку имеем разбавленный раствор малоустойчивого комплексного соединения (β1 = 112), образованием частиц, содержащих более одного лиганда, пренебрегаем. Это позволяет упростить уравнения материального баланса:
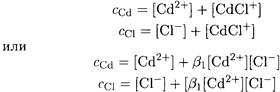
Из последнего уравнения найдем равновесную концентрацию иона кадмия:
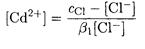
и подставим в уравнение материального баланса по кадмию
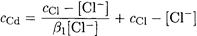
Рассчитываем равновесную концентрацию хлорид-иона:
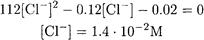
Теперь из уравнения материального баланса по хлорид-иону находим равновесную концентрацию иона кадмия:
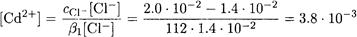
И, наконец, получаем значение равновесной концентрации CdCl+:

Эту задачу можно решать иначе. Если известны СМ и CL, то для расчета равновесных концентраций всех частиц можно воспользоваться функцией образования (формула 3-1):
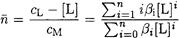
После преобразования получаем:

Пренебрегая существованием ионов CdCl3- и CdCl42-, находим:
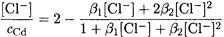
Отсюда
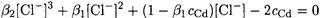
Поскольку первое слагаемое мало в сравнении с остальными, решаем квадратное уравнение

Зная [С1-], несложно рассчитать равновесные концентрации остальных частиц.
ПРИМЕР 6. Рассчитайте равновесную концентрацию хлорид-иона в 0.01 М растворе нитрата кадмия в присутствии 0.01 М соляной кислоты.
Решение. Принимая во внимание, что СCd = СCl, а ступенчатые константы устойчивости CdCl+ и CdCl2 заметно отличаются (112 и 3.55 соответственно), пренебрегаем существованием CdCl2 полагая, что доминирующей формой в растворе является CdCl+.
Следовательно, упрощенные уравнения материального баланса можно записать так:

или после преобразования

Находим из последнего выражения равновесную концентрацию иона кадмия:

и подставляем в уравнение материального баланса по кадмию. Далее, сделав преобразования, как в предыдущем примере, получаем квадратное уравнение по равновесной концентрации хлорид-иона:

Подставив числовые значения и решив уравнение

ПРИМЕР 7. В 2 М растворе роданида калия содержится 1·10-1 М Fe(NCS)52-. Какую концентрацию фторид-иона необходимо создать, чтобы концентрация Fe(NCS)52- понизилась до 1·10-5 М?
Решение. Реакция Fe(NCS)52- + 5F- ↔ FeF5-2 + 5NCS- характеризуется константой равновесия
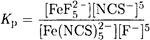
В справочных таблицах находим

Нетрудно видеть, что

Находим искомую величину [F-]:
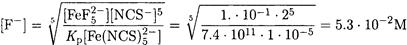
ПРИМЕР 8. Рассчитайте концентрацию несвязанного в комплекс кадмия (II) в растворе, полученном при сливании 50.0 мл 0.200 М раствора аммиака и 50.0 мл 0.0200 М раствора сульфата кадмия.
Решение. Общая концентрация аммиака значительно выше общей концентрации кадмия, поэтому уравнения материального баланса можно записать в упрощенном виде, полагая, что преобладает Cd(NH3)42+.
Запишем уравнения материального баланса по кадмию ипо аммиаку


Далее,
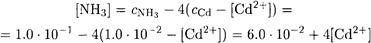
Подставляя найденные значения [NH3] и [Cd(NH3)42+] в выражение для β4, получаем
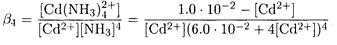
Упростим уравнение: поскольку концентрация аммиака довольно высокая, а комплекс устойчив, можно полагать, что концентрация несвязанного в комплекс кадмия мала. Поэтому

Рассмотрим другое возможное решение этой задачи. Поскольку C(NH3) > С(Cd), то полагаем, что преобладает Cd(NH3)42+ и его равновесная концентрация равна общей концентрации кадмия
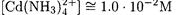
Для нахождения равновесной концентрации свободного аммиака воспользуемся выражением для среднего лигандного числа

Подставим найденные величины в выражение для β4:

|
|
|
|
|
Дата добавления: 2015-01-03; Просмотров: 8482; Нарушение авторских прав?; Мы поможем в написании вашей работы!