
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Расчет рН буферных растворов
|
|
|
|
Буферный раствор используют для поддержания постоянного значения рН. Он состоит из смеси слабой кислоты НА и сопряженного основания А-. В буферном растворе сосуществуют равновесия:
НА + Н2О ↔ Н3О+ + А-
А- + Н2О ↔ НА + ОН-
подавляющие друг друга при достаточно высоких С(НА) и С(А-); поэтому можно считать, что [НА] = С(НА) и [А-] = С(А-). Используя выражение для КаНА и пренебрегая вкладом [Н3О+] за счет диссоциации воды, получаем
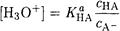 (2-14)
(2-14)
То же выражение можно получить, используя константу второго равновесия.
ПРИМЕР 16. Рассчитайте рН буферного раствора, состоящего из 0.10 М уксусной кислоты и 0.10 М ацетата натрия.
Решение. Здесь выполняются все условия, позволяющие применить формулу (2-14) (уксусная кислота - слабая кислота, концентрации кислоты и сопряженного основания достаточно высоки). Поэтому
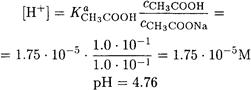
ПРИМЕР 17. Рассчитайте рН буферного раствора, состоящего из 0.10 М аммиака и 0.20 М хлорида аммония.
Решение. По формуле (2-14) находим
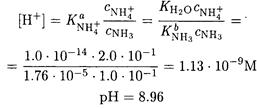
Важной характеристикой буферного раствора является буферная емкость. Добавление сильного основания (кислоты) к буферному раствору его рН может изменяться при изменении концентрации кислоты НА и сопряженного основания А-. Поэтому буферную емкость принято представлять в виде
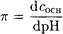 (2-16)
(2-16)
если к буферному раствору добавляется сильное основание, и
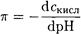
если к буферному раствору добавляется сильная кислота. Запишем уравнение материального баланса для смеси одноосновной кислоты НА и сопряженного основания А-:
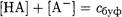
Выразим [НА] через КаНА и подставим в уравнение материального баланса. Найдем [А-]:
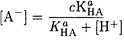 (2-17)
(2-17)
Дифференцируя уравнение (2-17) по dpH с учетом, что dcосн = [A-], получаем
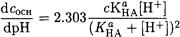 (2-18)
(2-18)
Нетрудно видеть, что при рН = pКаНА, т.е. – С(НА) = С(А-), достигается максимальная буферная емкость. Можно показать, что
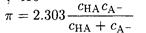 (2-19)
(2-19)
Формулы (2-18) и (2-19) вытекают одна из другой, если вспомнить, что [НА] = а (НА)С(НА) и [А-] = а (А-)С(А-),а также выражения для а (НА) и а (А-).
Для сильно разбавленных буферных растворов следует учесть вклад диссоциации воды. В этом случае уравнение (2-19) усложняется:
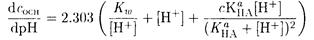 (2-20)
(2-20)
Здесь первые два слагаемые описывают буферное действие воды, третье - буферное действие кислоты и сопряженного основания.
ПРИМЕР 18. Рассчитайте, как изменится рН, если к 1.0 л буферного раствора, состоящего из 0.010 М уксусной кислоты и 0.010 М ацетата натрия, добавить 1.0·10-3 моль соляной кислоты.
Решение. Рассчитываем рН буферного раствора до добавления соляной кислоты:
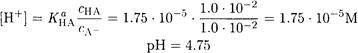
Общая концентрация буферного раствора равна
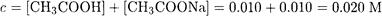
Для такого достаточно концентрированного буферного раствора буферную емкость следует рассчитывать по формуле (2-18):

Расчет но формуле (2-19) дает тот же результат:
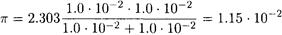
Рассчитываем изменение рН
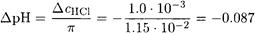
Таким образом, после добавления соляной кислоты рН буферного раствора составит
рН = 4.75 - 0.087 = 4.66
Эту задачу можно решить, не прибегая к расчету буферной емкости, а найдя количества компонентов буферной смеси до и после прибавления НС1. В исходном растворе

ПРИМЕР 19. Выведите выражение для максимальной буферной емкости раствора с общей концентрацией компонентов с.
Решение. Найдем условия, при которых буферная емкость максимальна. Для этого продифференцируем выражение (2-18) по рН и приравняем производную нулю
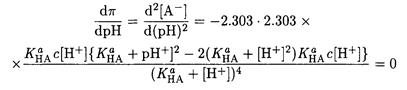
Отсюда [Н+] = КаНАи, следовательно, С(НА) = С(А-).
Используя формулы (2-19) и (2-21), получаем, что
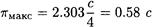
Расчет рН смесей кислот или оснований. Пусть в растворе содержатся две кислоты НА1 и НА2. Если одна кислота намного сильнее другой, то почти всегда присутствием более слабой кислоты можно пренебречь, так как ее диссоциация подавлена. В противном случае необходимо учитывать диссоциацию обеих кислот.
Если HA1 и НА2 не слишком слабые кислоты, то пренебрегая автопротолизом воды, уравнение электронейтральности можно записать в виде:
[Н3О+] = [А1-] + [A2-]
Найдем равновесные концентрации А1- и А21 из выражений для констант диссоциации НА1 и НА2:
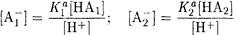
Подставим полученные выражения в уравнение электронейтральности
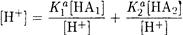
После преобразования получаем
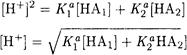
Если степень диссоциации кислот не превышает 5%, то
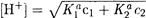
Для смеси из п кислот
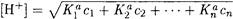 (2-20)
(2-20)
Аналогично для смеси одноосновных оснований
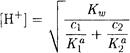 (2-21)
(2-21)
где Ка1 и Ка2 - константы диссоциации сопряженных кислот. На практике чаще, пожалуй, встречаются ситуации, когда одна (одно) из присутствующих в смеси кислот (оснований) подавляет диссоциацию других и поэтому для расчета рН можно учесть диссоциацию только этой кислоты (этого основания), а диссоциацией остальных пренебречь. Но могут встретиться и другие ситуации.
ПРИМЕР 20. Рассчитайте рН смеси, в которой общие концентрации бензойной и аминобензойной кислот равны соответственно 0.200 и 0.020 М.
Решение. Хотя величины констант диссоциации бензойной (Ка = 1.62·10-6, обозначим К1) и аминобензойной (Ка = 1.10·10-5, обозначим K2) кислот различаются почти на два порядка, из-за довольно большого различия концентраций кислот здесь необходимо учесть диссоциацию обеих кислот. Поэтому по формуле (2-20) находим
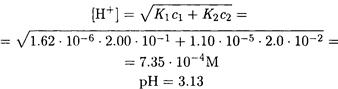
|
|
|
|
|
Дата добавления: 2015-01-03; Просмотров: 6729; Нарушение авторских прав?; Мы поможем в написании вашей работы!