
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Условие электронейтральности
|
|
|
|
Условие электронейтральности означает, что в единице объема сумма положительных зарядов равна сумме отрицательных зарядов, т. е. в общем виде

ПРИМЕР 6. Составьте уравнение электронейтральности для водного раствора нитрата калия.
Решение. В водном растворе нитрата калия имеются ионы К+, NО3- и ионы Н3О+ и ОН-, образующиеся при диссоциации воды. Уравнение электронейтральности поэтому следует записать так:
[К+] + [Н3О+] = [NO3-] + [ОН-]
ПРИМЕР 7. Составьте уравнение электронейтральности для водного раствора хлорида бария.
Решение. Здесь следует учесть, что в растворе присутствуют одно- и двухзарядные ионы. Это приводит к необходимости удвоения концентрации двухзарядного иона для соблюдения баланса зарядов, поскольку при диссоциации хлорида бария хлорид-ионов образуется в два раза больше, чем ионов бария. Итак,
2[Ва2+] + [Н3О+] = [Cl-] + [ОН-]
ПРИМЕР 8. Рассчитайте равновесную концентрацию карбонат-иона в 1.25·10-3 М растворе угольной кислоты при рН 6.00.
Решение. Запишем уравнение материального баланса для раствора угольной кислоты:
C(CO3) = [Н2СО3] + [НСО3-] + [СО32-]
Выразим равновесные концентрации гидрокарбонат-иона и угольной кислоты через искомую концентрацию карбонат-иона, воспользовавшись для этого выражениями для констант кислотности угольной кислоты, и подставим в уравнение материального баланса
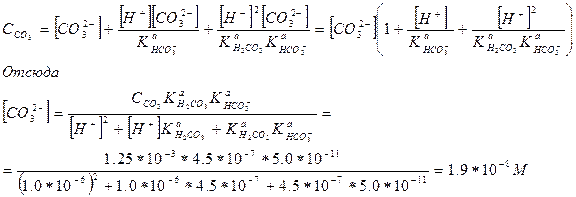
Существует два способа решения задачи при установлении в растворе более чем одного равновесия.
Первый способ предполагает следующий ход решения: после написания всех возможных для данной системы химических реакций, уравнений материального баланса и электронейтральности устанавливают, соответствует ли число неизвестных величин в уравнениях числу независимых уравнений. Если да, то решение системы уравнений затруднений вызвать не должно. И противном случае однозначное решение получить невозможно. Надо сократить число неизвестных, сделав ряд допущений. После получения приближенного решения рекомендуется проверить правомочность сделанных допущений.
По второму способу следует выделить доминирующее равновесие и уравнение материального баланса составить только с учетом этого равновесия. Например, при вычислении рН раствора соляной кислоты нужно написать два уравнения:
НСl + Н2О ↔ Н3О+ + Cl-
2Н2О ↔ Н3О+ + ОН-
В не очень разбавленных растворах доминирует первое равновесие, поскольку диссоциацией воды можно пренебречь.
В данном пособии используется, как правило, второй способ.
|
|
|
|
|
Дата добавления: 2015-01-03; Просмотров: 5387; Нарушение авторских прав?; Мы поможем в написании вашей работы!