
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Расчет э.д.с. электрохимической ячейки
|
|
|
|
Расчет формального потенциала полуреакции, протекающей с участием ионов водорода.
Для полуреакции Ох + ne + mH+ ↔ Red запишем уравнение Нернста
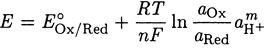
и преобразуем его

При а Ох = а Red = 1

Отсюда

где ЕОx/Red - потенциал полуреакции при рН 0.00.
ПРИМЕР 14. Рассчитайте формальный потенциал полуреакции NО2- + 2Н+ + е ↔ NO + Н2О при рН 1.00.
Решение. При рН 0.0 Е°(NO2-, 2H+/NO) = 1.202 В. Рассчитываем Е° полуреакции при рН 1.00 по формуле (5-13):

ПРИМЕР 15. При каком рН константа равновесия реакции между нитрит-ионом и иодид-ионом принимает значение больше 10?
Решение. Для реакции
2NO2- + 3I- + 4Н+ ↔ I3- + 2NO + Н2О
запишем выражение константы равновесия через формальный потенциал полу реакции:

Поскольку

Следовательно,

Электрохимическая ячейка (цепь) состоит из пары электродов, погруженных в раствор электролита. Электрод, на котором происходит восстановление, называют катодом, окисление - анодом. Разность потенциалов катода Ек и анода Еа определяет э.д.с. электрохимической ячейки Еяч:
Еяч = э.д.с = Ек- Еа
Если э.д.с > 0, полу реакция восстановления протекает самопроизвольно, такая электрохимическая цепь (ячейка) называется гальваническим элементом. Если э.д.с < 0. для протекания химической реакции требуется внешний источник энергии, и такую ячейку (цепь) называют электролитической.
Схематически электрохимические ячейки принято записывать слева направо так: анод, граница раздела фаз (вертикальная черта), электролит, солевой мостик (двойная черта), электролит, граница раздела фаз (вертикальная черта), катод.
ПРИМЕР 16. Запишите схематически ячейку, состоящую из цинкового электрода, погруженного в 0.1 М ZnSO4, и медного электрода, погруженного в 0.1 М CuSO4. Рассчитайте э.д.с. этой ячейки.
Решение. Согласно значениям Е °для гюлуреакций:
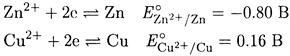
самопроизвольно протекает полуреакция восстановления Сu2+. Следовательно, цинковый электрод - анод, медный - катод. Схема предложенной в условии ячейки:
Zn|ZnSO4(0.1 M)||CuSO4(0.1 M)|Cu
Рассчитаем потенциалы анода и катода, приняв ионную силу, равной нулю.
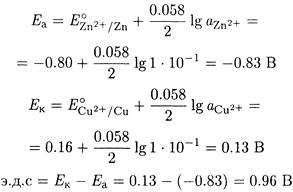
Следовательно, ячейка является гальваническим элементом (источником тока): в ней самопроизвольно протекает химическая реакция:
Cu2+ + Zn ↔ Сu + Zn2+
|
|
|
|
|
Дата добавления: 2015-01-03; Просмотров: 2691; Нарушение авторских прав?; Мы поможем в написании вашей работы!