
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Задачи на дом 3 страница
|
|
|
|
Протекание экзотермической реакции, связанной с выделением энергии в окружающую среду, приводит к уменьшению внутренней энергии вещества. Общий запас энергии данного вещества называют энтальпией (обозначают латинской буквой Н). В ходе реакции энтальпия изменяется, поэтому перед знаком Н указывают знак Δ (греч. буква «дельта»). Очевидно, что Q= – Δ Н.
Задание на дом
1. Какова молярная теплота образования Al2O3, если установлено, что
4Al + 3 O2 = 2Al2O3 + 3350 кДж/моль
2. Сколько граммов NO образовалось, если израсходовано 9037 кДж, а на получение 1 моль NO требуется 90,4 кДж?
3. При сгорании 6 г графита получено 198 кДж. Сколько теплоты выделится при сгорании 960 г графита.
4. В каком соотношении по массе надо смешать уголь и карбонат кальция, чтобы, начавшись, реакция горения угля и разложения карбонатам кальция протекала без отвода теплоты и без его подвода из окружающей среды. Значения теплового эффекта горения угля в кислороде и разложения С аСО3 приведены в материале лекции.
Задачи на растворимость веществ
1. Растворимость сульфата меди (в граммах на 100 г воды) составляет: 14,3 (0оС) и 39,5 (60оС). Сколько граммов медного купороса CuSO4.5H2O выпадет в осадок при охлаждении до 0оС 500 г раствора сульфата меди, насыщенного при 60оС?
2. Растворимость сульфата меди (в граммах на 100 г воды) составляет: 14,3 (0оС), 23,5 (25оС) и 39,5 (60оС). В каком соотношении по массе надо смешать растворы сульфата меди, насыщенные при 0оС и при 60оС, чтобы получить раствор, насыщенный при 25оС?
3. Сколько граммов медного купороса CuSO4.5H2O надо добавить к 300 г. раствора сульфата меди, насыщенного при 25оС, чтобы получить раствор сульфата меди, насыщенный при 60оС, если растворимость CuSO4 при 60оС составляет 39,5 г (граммы на 100 г воды)?
4. Сколько граммов насыщенного при 60оС раствора сульфата меди надо охладить до 0оС, чтобы получить 100 г CuSO4·5H2O? Растворимость сульфата меди (в граммах на 100 г воды) составляет: 14,3 (0оС) и 39,5 (60оС).
Тема 8. Основы химической кинетики. Скорость химических реакций. Зависимость скорости реакции от концентрации и температуры. Энергия активации. Катализ и катализаторы.
Химическая кинетика – учение о законах протекания химических процессов во времени, их механизмах и скоростях. Химические реакции по-разному протекают в различных системах.
Системы в химии – рассматриваемое вещество или совокупность веществ. Системы подразделяют на закрытые (для них отсутствует массообмен с окружающей средой) и открытые (массообмен есть). Значительно проще рассматривать закрытые системы, о которых и будет идти речь далее.
В системах выделяют их части – фазы. Фаза – часть системы, отделенная от других частей поверхностью раздела, при переходе через которую макросвойства (плотность, цвет и др.) изменяются скачком. Системы, состоящие из одной фазы, называют гомогенными, из нескольких фаз – гетерогенными. Реакции, протекающие в одной фазе, называют гомогенными, в системах, состоящих из нескольких фаз, – гетерогенными. Гомогенные реакции протекают в объеме, гетерогенные – на поверхности раздела фаз. Примеры гетерогенных реакций:
Zn+ 2HCl = ZnCl2 + H2↑; CaCO3 + 2HNO3 = Ca(NO3)2 + CO2↑+ H2O
Далее рассмотрены закрытые системы, в которых протекают гомогенные реакции (реакции в газе или в растворе).
Примем, что стенки, отделяющие данную систему от окружающего мира, обладают высокой теплопроводностью, и температура внутри всей системы всегда равна температуре окружающей среды.
Примеры гомогенных реакций:
NO + CO2 = NO2 + CO; 2H = H2; 2CO + O2 = 2CO2
Эти реакции протекают в газовой фазе. Гомогенные реакции могут протекать и в растворах. Например, в водном растворе могут протекать такие реакции:
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑; 2KOH + H2SO4 = K2SO4 + H2O
В основе химической кинетики лежат два постулата. Во-первых, для того, чтобы две микрочастицы (атомы, молекулы, ионы) могли вступить во взаимодействие друг с другом, они должны войти в прямой контакт, столкнуться одна с другой. Во-вторых, далеко не каждое столкновение микрочастиц приводит к их взаимодействию, протеканию реакции. Реакция, как правило, возможна, если энергия сталкивающихся микрочастиц выше некоторого определенного значения.
Понятно, что, чем больше число частиц реагентов в данной системе, тем большее их число может столкнуться в единицу времени и вступить во взаимодействие. Число частиц реагента отражает его количество, выраженное числом молей. С учетом этого понятно, почему скорость гомогенной реакции принято характеризовать через число молей реагента, вступившего в реакцию в единицу времени. Для того чтобы можно было сравнивать различные реакции между собой, число молей реагента, вступившего в реакцию в единицу времени, относят к объему системы. Объем системы в химической кинетике чаще всего выражают в кубических дециметрах (литрах).
Отношение количества вещества (числа молей) к объему, которое данное вещество занимает, называют молярной концентрацией. Молярную концентрацию обозначают как моль/л (или моль/дм3). Возможны также записи типа моль·л-1 или моль·дм-3. Для низких концентраций возможно также обозначение ммоль/л и аналогичные.
На скорость химических реакций влияют следующие факторы:
1. Природа реагирующих веществ. Так, реакция фтора и водорода протекает с взрывом просто при контакте этих газов между собой:
H2 + F2 = 2HF + Q
А реакция водорода с кислородом
2H2 + О2 = 2H2О + Q
при комнатной температуре протекает так медленно, что, по расчетам ученых, первые капли продукта реакции – воды – в реакционном сосуде появятся только через несколько миллионов лет.
2. Молярная концентрация реагентов. Чем выше молярная концентрация, тем выше скорость реакции. Если запись реакции отражает элементарный акт взаимодействия молекул (столкновение молекул, которое может привести к продукту реакции), то скорость реакции пропорциональна произведению молярных концентраций реагентов. Сказанное справедливо, например, для реакции двух газов:
NO2 + CO = NO + CO2
Для нее зависимость скорости v от молярных концентраций реагентов имеет вид
v = k [NO2 ] [CO]
В этом выражении коэффициент пропорциональности k – константа скорости реакции (численное значение константы скорости отражает природу реагирующих веществ). Квадратные скобки указывают на то, что используют молярные концентрации соответствующих веществ.
Численное значение константы скорости k равно скорости реакции при таких условиях, при которых произведение молярных концентраций реагентов равно 1 (т.е. в приведенном примере [NO2][CO] = 1. Размерность k чаще всего подбирают такой, чтобы значение скорости оказалось безразмерным (в данном случае размерность k л2моль-2).
Число участвующих в элементарном акте молекул – это молекулярность данной реакции. Известны моно- и бимолекулярные реакции. Ранее считали, что могут быть и тримолекулярные реакции (реакции, при протекании которых одновременно, т.е. за время порядка 10-16-10-15 с, сталкиваются три молекулы), но исследования, выполненные во второй половине ХХ века, показали, что большинство таких реакций на самом деле протекает через последовательные столкновения двух молекул. Так, реакция
2NO + O2 = 2NO2
не тримолекулярная, как считали ранее, а протекает через две последовательные бимолекулярные стадии:
2NO = N2O2 и N2O2 + O2 = 2NO2
Поэтому запись зависимости скорости реакции 2NO + O2 = 2NO2
от молярных концентраций реагентов как v = k [NO]2[CO] ошибочна.
Сумма степеней в выражении для зависимости скорости реакции от концентрации – это порядок реакции. Если молекулярность реакции – всегда целое число, то порядок реакции может быть и целочисленным, и дробным. Дробность указывает на то, что реакция протекает через несколько стадий, причем скорости стадий соизмеримы между собой. Если же реакция протекает через несколько стадий, а скорость одной из них значительно меньше скоростей других стадий, то такую медленную стадию называют скорость определяющей.
Кроме сложных реакций (реакций, протекающих через две или большее число последовательных стадий) типа реакции между NO и O2, известны и многочисленные так называемые цепные реакции, протекание которых связано с длинными цепочками последовательных превращений. К числу цепных реакций относятся реакции водорода и метана с кислородом, водорода с хлором и многие другие. Для этих реакций зависимость скорости от концентрации реагентов имеет сложный характер.
Большой вклад в изучение кинетики цепных реакций внесли Лауреаты Нобелевской премии наш соотечественник Н.Н.Семенов и англичанин С.Н. Хиншелвуд.
3. Температура. Чем выше температура реагентов, тем с большими скоростями движутся реагирующие молекулы и тем чаще будут происходить их столкновения друг с другом. Поэтому с ростом температуры скорости подавляющего большинства реакций растут, и растут довольно быстро. Во второй половине ХIХ века голландский ученый Я.Х.Вант-Гофф сформулировал правило, согласно которому при повышении температуры на каждые 10о скорость реакции возрастает в 2-4 раза. Число, показывающее, во сколько раз возрастает скорость реакции при повышении температуры на 10о, иногда называют коэффициентом Вант-Гоффа. График, иллюстрирующий правило Вант-Гоффа, показан на рис. 15.

Рис. 15. Экспоненциальное изменение скорости реакции с ростом температуры по правилу Вант-Гоффа
Позднейшие исследования показали, что правило Вант-Гоффа выполняется в области температур, не более чем на 80-150оС выше температуры начала реакции. При более высокой температуре возрастание скорости с ростом температуры постепенно отклоняется от экспоненты и переходит в линейную. На рис. 15 показан типичный график зависимости скорости реакции от температуры – изменение с нагреванием скорости разложения аммиака на азот и водород (скорость реакции становится заметной при 230-250оС).
Причины сильной зависимости скоростей реакции от температуры приближенно состоят в следующем. Средняя энергия молекул газа E, находящихся при температуре Т, равна Е = 3/2 kT, где k – константа Больцмана. Энергия отдельных молекул при этом различается в широких пределах, причем распределение молекул по энергии передает уравнение Максвелла-Больцмана.

Рис.16. Изменение с ростом температуры скорости разложения аммиака на азот и водород
Полученная с использованием этого уравнения кривая (рис.16), отвечающая распределению частиц по энергии при температуре Т 1, характеризуется максимумом, который находится вблизи средней энергии молекул Е. Незначительная доля молекул с энергией выше энергии активации в данном случае очень мала.
С ростом температуры доля во всей совокупности молекул тех из них, чья энергия выше энергии активации, быстро увеличивается (на рис. 16 кривая, отвечающая температуре Т2 > Т1), поэтому и скорость реакции быстро увеличивается. Этому увеличению, которое наблюдается уже при незначительном повышении температуры, отвечает рост площади заштрихованной области под кривой, соответствующей температуре Т2 (рис.17).
Существуют реакции, энергия активации которых близка к 0 (например, реакции нейтрализации). Скорости таких реакций, во-первых, довольно высоки и, во-вторых, не зависят от температуры.
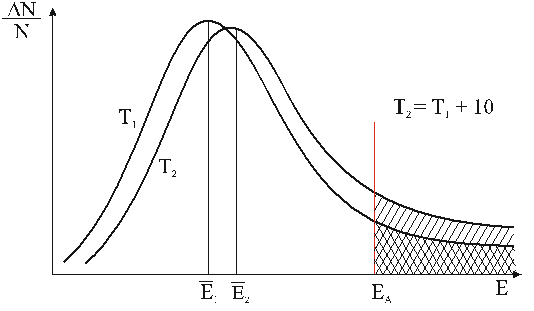
Рис.17. Кривые распределения молекул газа по энергии Е при температурах Т1 и Т2 (Т2 > Т1).
ΔN/N – доля молекул ΔN с энергией Е от всех молекул N
Зависимость скорости реакции v от температуры T (K) передает уравнение Аррениуса (предложено С.Аррениусом в 1889 г.):
v = v о е- Е А/ RT,
где е – число, приблизительно равное 2,712 (основание натуральных логарифмов), R – газовая постоянная, T – температура; v о – множитель, характеризующий общее число столкновений молекул реагентов в единицу времени; множитель е- Е А/ RT характеризует долю столкновений молекул, в результате которых может произойти реакция.
4. Наличие катализатора. Существует большое число реакций, скорость которых резко возрастает с введением в реакционную систему небольших количеств специальных добавок – катализаторов. После завершения реакции катализатор не входит в состав продуктов реакции и часто может быть использован многократно. Такие реакции называют каталитическими. Примеры каталитических реакций: разложение пероксида водорода H2O2 на воду и кислород (катализатор этой реакции – MnO2), разложение хлората калия KClO3 на кислород и хлорид калия KCl (катализатор также MnO2) и др.
Смысл использования катализатора состоит в направлении реакции по пути с меньшей энергией активации. Использование катализаторов или ускоряет реакцию (как в случае разложения пероксида водорода), или направляет ее по другому пути (как в случае разложения хлората калия, который без катализатора разлагается на хлорид калия и перхлорат калия KClO4).
Если реакция протекает в гомогенной системе и введенный в систему катализатор не нарушает ее гомогенности, то такой катализ называют гомогенным. В других случаях речь идет о гетерогенном катализе. Примеры гетерогенного катализа были приведены выше. Пример гомогенного катализа – окисление оксида серы(IV) кислородом до оксида серы (VI) в присутствии оксида азота(IV).
Скорость гетерогенных реакций в первую очередь зависит от площади раздела реагирующих фаз – чем сильнее измельчено вещество, тем выше скорость. В общем случае скорость гетерогенной реакции зависит от скорости подачи реагентов к границе раздела фаз и скорости отвода продукта реакции от этой границы. Так, на поверхности чистого алюминия, внесенного в атмосферу кислорода, мгновенно протекает реакция образования оксида алюминия Al2O3. Оксид алюминия – тугоплавкое нелетучее вещество, блокирующее доступ кислорода к поверхности алюминия. И реакция после формирования пленки оксида алюминия толщиной в несколько микрометров сразу же прекращается.
Задание на дом
1. Учитывая правило Вант-Гоффа, рассчитайте, во сколько раз увеличится скорость реакции при повышении температуры на 60оС, если температурный коэффициент (коэффициент Вант-Гоффа) равен 3.
2. Каков график зависимости скорости реакции нейтрализации от температуры?
3. Для реакции H2 + I2 = 2HI зависимость скорости реакции от концентрации реагентов в газовой фазе передает уравнение v = k [H2][I2]. При 508оС значение k = 0,16 л2моль-2. Исходные концентрации составили: [H2] 0,06 моль/л, [I2]0,04 моль/л. Какова скорость реакции в исходный момент времени? Какой станет скорость реакции в момент, когда концентрация [H2] составит 0,05 моль/л?
Тема 9. Обратимые и необратимые реакции. Химическое равновесие. Смещение равновесия. Принцип Ле Шателье. Роль энергетического и энтропийного факторов при протекании химических реакций
Химические реакции подразделяют на обратимые и необратимые. Необратимые реакции протекают только в одном направлении. Примеры необратимых реакций – реакции горения, реакции, приводящие к образованию очень мало растворимых веществ (например, сульфида ртути HgS) и др. Известны также и обратимые реакции, в которых продукты прямой реакции вступают между собой во взаимодействие, в результате которого могут образовываться исходные вещества. Так, пары иода и газ водород реагируют, образуя иодоводород HI. Но молекулы иодоводорода также могут реагировать друг с другом, и в результате вновь образуются исходные вещества.
Для обозначения обратимых реакций используют знак ⇄. Он показывает, что данная реакция может протекать как в прямом, так и в обратном направлении. Так, обратимость указанной выше реакции передают следующим образом:
H2 + I2 ⇄ 2HI
Протекание обратимой реакции в закрытой системе при постоянной температуре может привести к состоянию равновесия. Строго говоря, равновесие – это такое состояние закрытых систем, находящихся при постоянной температуре, при котором макроскопические свойства каждой части системы не изменяются с течением времени, как бы долго ни велось наблюдение за системой.
Макроскопические свойства – это свойства, обусловленные действием сразу большого числа атомов, молекул, ионов (вязкость, цвет, плотность и др.). Микросвойства – это свойства отдельных атомов, молекул, ионов (скорость и направление движения, частота колебаний). При равновесии микросвойства отдельных частиц могут сильно отличаться друг от друга.
Доказательство достижения равновесия – это достижение одного и того же конечного состояния при разных исходных состояниях. Например, пусть обратимую реакцию
2Н2О ⇄ 2Н2 + О2
изучают при 2000оС. Первое исходное состояние в этой системе: содержание паров воды 1 моль, водорода и кислорода нет. Через некоторое время оказалось, что содержание паров воды 0,994 моль, водорода – 0,006 моль, кислорода 0,003 моль (конечное состояние в первом случае).
Второе исходное состояние: в той же системе паров воды нет, водорода 1 моль, кислорода 0,5 моль. Спустя какое-то время оказалось, что в системе содержится 0,994 моль паров воды, 0,006 моль водорода и 0,003 моль кислорода. Видно, что при двух разных исходных состояниях система пришла к одному и тому же конечному состоянию. Это совпадение означает, что в системе установилось равновесие.
Авторы некоторых пособий по химии считают, что состояние равновесия наступает, когда скорости прямой и обратной реакций становятся равными, т.е. v пр = v обр. Строго говоря, это не совсем точно.
Если система находится в состоянии равновесия, то при любом воздействии на эту систему, вызывающем нарушение достигнутого равновесия (изменение температуры, концентрации или давления) система переходит в такое новое состояние, при котором эффект внешнего воздействия ослабевает. Этот принцип сформулировал в 1875 г. французский физико-химик А.Л. Ле Шателье и теоретически обосновал несколькими годами позднее немецкий ученый Ф.Браун.
Химическое равновесие при данной температуре Т характеризуют константой равновесия К. Для реакции, записанной как
аА + bB ⇄ cC + dD
константа равновесия при температуре Т равна:
K = 
В выражении для константы равновесия К в числителе указывают молярные концентрации веществ – продуктов реакции, а в знаменателе – молярные концентрации исходных веществ. Каждую молярную концентрацию в выражении для константы равновесия приводят в той степени, какая отвечает коэффициенту перед соответствующим веществом в уравнении реакции.
Сместить равновесие можно: а) при постоянной температуре (значение константы равновесия К при этом остается неизменным) и б) при изменяющейся температуре (значение К изменяется с изменением температуры). Если реакция протекает с участием газов, то сместить равновесие можно, изменяя давление. Рассмотрим в качестве примера две обратимые реакции:
Н2 + I2 ⇄ 2HI; 3H2 + N2 ⇄ 2NH3
Выражения для констант равновесия K этих реакций при исходных состояниях, отвечающих, например, давлению 0,1 МПа, имеют вид
K1 =  K2 =
K2 = 
Если в каждой из этих двух систем давление мгновенно увеличить, например, в 2 раза, то в этих выражениях все концентрации мгновенно тоже вырастут в 2 раза, и выражения будут иметь вид:
 =
= 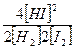 = K1;
= K1;  = -
= - 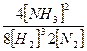 =
=  ≠
≠
≠ K2
Видно, что значение первого выражения сохранилось равным K1; из этого факта следует, что равновесие не сместилось. Во втором случае выражение стало в 4 раза меньше K2. Однако значение константы равновесия должно остаться постоянным, поэтому числитель в этом случае должен вырасти (молярная концентрация аммиака должна дополнительно увеличиться), а знаменатель – уменьшиться (молярные концентрации азота и водорода должны уменьшиться). Следовательно, равновесие реакции синтеза аммиака сместится вправо, в сторону образования аммиака.
Отметим, что протекание этой реакции сопровождается уменьшением числа молекул в системе, а при протекании реакции образования иодоводорода число молекул сохраняется, и смещения равновесия нет. В результате внешнее воздействие на систему, где происходит синтез аммиака (первоначальное увеличение давления), снизится, что и отражает принцип Ле Шателье. Равновесие, следовательно, в этом случае смещается вправо, в сторону уменьшения давления. А в случае образования иодоводорода, когда изменения числа молекул при протекании реакции нет, повышение давления к смещению равновесия не приведет.
Таким образом, если протекание обратимой реакции слева направо сопровождается уменьшением числа молекул, то повышение давления в системе приводит к смещению равновесия вправо. В противном случае, при увеличении числа молекул в результате протекания прямой реакции, повышение давления в системе приводит к смещению равновесия влево. Если изменения числа молекул при протекании реакции нет, то изменение давления не будет влиять на состояние равновесия.
Если протекание прямой реакции сопровождается выделением теплоты (реакция экзотермическая), то повышение температуры приведет к смещению равновесия влево (в сторону образования исходных веществ). Так, равновесие обратимой реакции синтеза аммиака
3H2 + N2 ⇄ 2NH3 + Q
при повышении температуры сместится влево, и равновесная концентрация аммиака в системе уменьшится. Протекание обратной реакции разложения аммиака связано с поглощением теплоты. Поэтому повышение температуры приведет к усилению разложения аммиака на азот и водород, и эффект внешнего воздействия (дополнительное подведение теплоты) при таком смещении снизится.
Введение в систему катализатора не вызывает смещения равновесия, так как катализатор ускоряет в равной степени прямую и обратную реакции. Катализатор способствует более быстрому достижению равновесия в системе.
Чем обеспечивается самопроизвольное протекание реакций? Очевидно, прежде всего оно обусловлено выделением энергии в окружающую среду и понижением суммарной внутренней энергии системы, что наблюдается для экзотермических реакций. Это – энергетический (энтальпийный) фактор, обусловливающий протекание реакции. Но с чем же тогда связана возможность протекания эндотермических процессов? Например, в большинстве случаев растворение веществ в воде – эндотермический процесс. В этом случае самопроизвольное протекание процесса связано с действием другого фактора, который называют энтропийным.
Энтропия (общепринятое обозначение S) – это мера хаотичности распределения частиц (атомов, молекул, ионов) в пространстве. Чем более хаотично распределены указанные частицы в системе, тем выше энтропия системы (общепринятое обозначение изменения энтропии ΔS; по ряду соображений влияние энтропийного фактора характеризуют через произведение ТΔS, где Т – температура, К). Больше всего энтропия (хаотичность расположения частиц в пространстве) у газов, меньше всего – у совершенных кристаллов при температуре, близкой к 0 К.
В природе процессы самопроизвольно обычно протекают в том направлении, в каком энтропия системы возрастает.
Для того чтобы реакция была обратимой, необходимо, чтобы действие энтальпийного (энергетического) и энтропийного фактора было разнонаправлено. Так, при взаимодействии углекислого газа и оксида кальция теплота выделяется:
СаО + СО2 = СаСО3 + Q
а энтропийный фактор при протекании этой реакции действует в обратном направлении: при образовании СаСО3 из СаО и СО2 теплота выделяется, но упорядоченность в расположении атомов С, О и Са в пространстве возрастает и энтропия уменьшается. Следовательно, реакция
СаО + СО2 ⇄ СаСО3
может быть обратимой, что и наблюдается на практике при нагревании (при температуре 1000-1500оС эта реакция обратима).
Заметим, что для этой реакции выражение для константы равновесия имеет вид:
К = 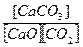 -----------------,
-----------------,
причем при фиксированной температуре [СаСО3 ] = const и также [СаО] = const, так что
К =  =[СО2]-1 и К = (р СО2) -1 ,
=[СО2]-1 и К = (р СО2) -1 ,
причем р СО2– парциальное равновесное давление СО2 в системе.
Если оба фактора – и энтальпийный, и энтропийный, действуют в одном направлении (энергия выделяется в окружающую среду, а энтропия возрастает), то реакция будет принадлежать к числу необратимых. В этом случае считают, что оба фактора действуют в одном направлении. Так, при горении пропана С3Н8 теплота выделяется (энергосодержание системы – энтальпия – уменьшается), а энтропия возрастает – в молекулах пропана атомы С и Н находятся в сравнительно упорядоченном состоянии, а в находящихся в газе молекулах воды и углекислого газа – в менее упорядоченном состоянии:
С3Н8 + 5О2 = 3СО2 + 4Н2О + Q
Данная реакция принадлежит к числу необратимых – из углекислого газа и паров воды синтезировать пропан нельзя.
Задание на дом
1. Учитывая известную из бытовой практики зависимость растворимости кислорода в воде от температуры, укажите знак теплового эффекта, отвечающий растворению в воде кислорода.
2. В каком направлении сместится равновесие, если из равновесной системы 2NH3 ⇄ 3H2 + N2 удалять часть аммиака (например, поглощая его активированным углем)?
3. Тепловой эффект растворения хлора в воде отрицательный:
Cl2 + H2O ⇄ HCl + HOCl – Q
Какими путями можно сместить равновесие этой обратимой реакции вправо?
4. Тепловой эффект растворения нитрата калия KNO3 в воде отрицательный. Как изменяется растворимость нитрата калия в воде с ростом температуры?
5. В закрытой системе протекает реакция 2А ⇄ В + 3С. В начальный момент в систему ввели 12 моль А. При достижении равновесия в системе обнаружено 6 моль С. Каково значение константы равновесия?
6. В закрытой системе протекает реакция А ⇄ 2В + 2С. В начальный момент в систему ввели 10 моль А. При достижении равновесия в системе обнаружено 4 моль С. Каково значение константы равновесия?
Тема 10. Растворы и растворимость
|
|
|
|
|
Дата добавления: 2015-01-03; Просмотров: 766; Нарушение авторских прав?; Мы поможем в написании вашей работы!