
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Задачи на дом 4 страница
|
|
|
|
Раствором называют жидкую или твердую гомогенную систему, состоящую из двух или большего числа исходных веществ (компонентов), относительное содержание которых в системе может изменяться в широких пределах. Растворы обычно устойчивы во времени. Образование растворов, как и химических соединений, обычно сопровождается тепловыми эффектами. Главное отличие растворов от химических соединений – переменный состав растворов и постоянный – химических соединений..
В растворе условно выделяют растворенное вещество и растворитель. Растворитель может быть жидким или твердым, растворенное вещество – газообразным, жидким или твердым. Растворитель – это вещество, которое при данных условиях существует в том же агрегатном состоянии, что и образовавшийся раствор. Так, если 700 мл водорода растворить в 1 см3 металла палладия, то растворителем будет палладий, так как при обычных условиях и он, и образующийся раствор – твердые вещества.
Если оба вещества, образующие раствор, находятся в одном и том же агрегатном состоянии, то растворителем считают то из них, которого больше. Так, если 50 г ацетона растворить в 70 г спирта, то спирт рассматривают как растворитель, а ацетон – как растворенное вещество. Однако, если одно из веществ, образующих раствор – вода, то воду считают растворителем вне зависимости от того, каково ее относительное содержание в растворе. Например, известны 96%-й раствор спирта в воде, 98%-й раствор серной кислоты и т.д.
Рассмотрим растворение какого-либо твердого вещества А в жидкости (в школьном курсе обычно речь идет о водных растворах). Скорость растворения v А пропорциональна скорости удаления частиц с единицы поверхности k1 и общей поверхности кристаллов S:
v А = k1S.
Скорость обратного процесса – перехода вещества из раствора в кристаллы (скорость осаждения v ОС) пропорциональна числу частиц растворенного вещества А в единице объема раствора (молярной концентрации [А] в растворе), площади поверхности кристаллов S и скорости выделения А на единичной поверхности кристаллов k2:
v ОС= k2S [A]
Если при данной температуре устанавливается равновесие, то скорости растворения и осаждения сравниваются, и
vА = k1S = k2S [A] = v ОС
или k1 = k2 [A], т.е.
К = k1/ k2 = [A] = const
Таким образом, при равновесии концентрация вещества в среде определенного растворителя при выбранной температуре [A] постоянна.
Равновесное содержание растворенного вещества в растворе при данной температуре принято указывать в расчете на 100 г растворителя (например, 100 г воды). Такое равновесное содержание называют растворимостью вещества. Изменение растворимости с температурой передает так называемая кривая растворимости. Количественная мера растворимости – это концентрация насыщенного раствора или масса растворенного вещества, приходящаяся на 100 г растворителя.
Если содержание вещества в растворе отвечает установлению при данной температуре равновесия между твердой фазой и раствором, то такой раствор называют насыщенным. Если содержание вещества ниже равновесного значения, то раствор называют ненасыщенным.
Обычно с увеличением температуры растворимость вещества в воде растет. В соответствии с принципом Ле Шателье это означает, что в таких случаях растворение – это эндотермический процесс (встречаются и случаи образования водных растворов, когда теплота при растворении выделяется).
Результирующий тепловой эффект при растворении обусловлен действием двух факторов. Первый фактор – это затраты энергии на разрушение кристаллической структуры при переходе вещества из твердой фазы в раствор. Второй фактор – это выделение теплоты при взаимодействии перешедших в раствор частиц с растворителем (в случае воды – это энергия присоединения молекул воды к перешедшей в раствор частице, энергия ее гидратации). Нужно также учесть, что при растворении возрастает хаотичность расположения микрочастиц системы в пространстве (растет энтропия), и это благоприятствует самопроизвольному течению растворения. Результирующий тепловой эффект растворения (теплота растворения) обусловлен действием этих двух факторов.
В общем случае взаимодействие содержащихся в растворе микрочастиц растворенного вещества с растворителем называют сольватацией. Если растворитель – вода, то такое взаимодействие называют гидратацией.
Из сказанного об отрицательном тепловом эффекте растворения в воде большинства веществ можно заключить, что на разрушение кристаллической структуры при растворении в воде чаще всего расходуется больше энергии, чем выделяется при гидратации растворенных частиц.
В случае растворения газов в воде энергия на разрушение кристаллической решетки не затрачивается, а энергия гидратации молекул газа выделяется. Поэтому растворение газов в воде чаще всего сопровождается положительным тепловым эффектом, и растворимость газов в воде с ростом температуры падает.
Чаще всего с ростом температуры растворимость вещества в воде увеличивается. Предположим, что раствор, насыщенный при какой-либо повышенной температуре, осторожно (не перемешивая, не встряхивая) охлаждают. Часто в таких случаях выделения твердой фазы при достижении более низкой температуры не наблюдается, и содержание вещества в растворе оказывается выше того, которое соответствует насыщенному раствору. Такие растворы называют пересыщенными. В отличие от ненасыщенных и насыщенных растворов пересыщенные растворы метастабильны – хотя часто их можно хранить очень долго, рано или поздно из них происходит выделение «избыточного» растворенного вещества. Выделение из них избыточного вещества наблюдается, например, при внесении в такой раствор затравки – небольшого кристаллика растворенного вещества, или при трении стеклянной палочкой о стенки сосуда, в котором находится пересыщенный раствор.
Растворы часто подразделяют на разбавленные и концентрированные. Четкой границы между ними нет. Обычно разбавленными называют такие растворы, в которых содержание растворенного вещества мало (менее 1 г на 100 г раствора). Поведение растворенных частиц в разбавленном растворе не зависит от присутствия в растворе других частиц этого или какого-либо другого растворенного вещества.
Если введение дополнительной порции растворяемого вещества в раствор приводит к изменению поведения микрочастиц в растворе (изменению их гидратации), то такой раствор относят к числу концентрированных. Концентрированными могут быть и насыщенные, и ненасыщенные растворы.
Чаще всего содержание растворенного вещества в растворе выражают через массовую (мольную) долю или через молярную концентрацию. Массовая доля растворенного вещества w (дубль вэ) равна
w = 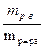 =
= 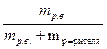
где m р.в. – масса растворенного вещества, m р-ра – масса раствора, m р-ритель – масса растворителя. Массовую долю растворенного вещества выражают или в долях единицы, или в процентах.
Молярная концентрация, как уже было сообщено в разделе 7, – это отношение числа молей растворенного вещества к объему раствора, выраженному в кубических дециметрах или в литрах.
Кроме массовой доли и молярной концентрации, существуют многие другие способы выражения содержания в растворе растворенного вещества. К их числу принадлежат: а) титр раствора – масса растворенного вещества (в миллиграммах и т.п. единицах) в 1 мл раствора, б) нормальность раствора (число молей вещества, деленное на число эквивалентности данного соединения в 1 л раствора. Например, для серной кислоты, для которой число эквивалентности равно 2, однонормальный раствор – это раствор, содержащий 98:2 = 49 г H2SO4 в 1 л раствора; в) моляльность раствора (число молей растворенного вещества, приходящееся на 1 кг растворителя) и др.
Задание на дом
1. Сколько граммов хлорида натрия надо внести в 100 г воды, чтобы приготовить 10%-й раствор?
2. Сколько литров (н.у.) газа хлороводорода надо дополнительно растворить в 200 мл 20%-й соляной кислоты (плотность 1,1 г/см3), чтобы получить 30%-ю соляную кислоту?
3. Сколько миллилитров воды и 25%-го раствора серной кислоты надо взять для приготовления 1 кг 12%-го раствора серной кислоты?
4. Как экспериментально различить ненасыщенный, насыщенный и пересыщенный растворы?
5. 500 г ВаCl2·2H2O растворили в 10 л воды. Какова массовая доля хлорида бария в полученном растворе?
6. Укажите все факторы, позволяющие повысить скорость растворения сахара в воде.
Тема 11. Водные растворы электролитов. Степень диссоциации. Реакции между растворами электролитов – реакции между ионами. Ступенчатая диссоциация слабых и средних по силе кислот.
При растворении в воде соединений с ионным типом связи – а это все щелочи и почти все соли – в растворе оказываются соответствующие ионы – катионы и анионы. Эти ионы гидратированы, каждый из них окружен 20-25 молекулами воды (маленькими биполярными частицами – диполями). Существование щелочей и солей в растворах в виде гидратированных ионов передают следующие записи:
Ва(OH)2 + aq = Ba2+ ·aq + 2OH - aq; Al2(SO4)3 + aq =2Al3+ aq + 3SO42- aq
В этих записях aq – условное обозначение молекул воды, участвующих в растворении и гидратации и онов. Обычно в записях это обозначение опускают:
Ва(OH)2 = Ba2+ + 2OH - ; Al2(SO4)3 =2Al3+ + 3SO42-
Химические соединения, которые в водном растворе или расплаве существуют в виде катионов или анионов, называют электролитами. Наличие ионов обусловливает способность растворов и расплавов проводить электрический ток.
Если в растворе растворенное вещество существует только в виде ионов, то такое вещество относят к числу сильных электролитов.
Записи, отражающие существование в растворе сильных электролитов в виде ионов, имеют вид:
KCl = K+ + Cl -; Fe(NO3)3 = Fe3+ + 3NO3 - ; (NH4) 2SO4 =2NH4+ + SO42-
Иногда в отечественной литературе такие записи называют «уравнениями электролитической диссоциации». Такое название возникло около 100 лет назад, когда считалось, что все вещества имеют молекулярное строение и молекулы в водном растворе распадаются (диссоциируют) на ионы. На самом же деле распада на ионы нейтральных молекул нет, так как в случае сильных электролитов в кристаллической структуре нет молекул, а существуют «готовые» ионы, которые при растворении в воде гидратируются. Именно поэтому бессмысленно записывать «ступенчатую диссоциацию» на ионы таких сильных электролитов, как Ва(ОН)2, Fe(NO3)3, (NH4) 2SO4 и др.
К числу сильных электролитов принадлежат: щелочи, почти все соли (исключения: HgCl2, HgBr2, фториды некоторых переходных элементов и некоторые другие) и многие кислоты, в которых атом водорода связан с кислотным остатком полярной ковалентной связью.
В число кислот – сильных электролитов, существующих в растворе только в виде ионов, входят следующие бескислородные кислоты: соляная HCl, бромоводородная HBr, иодоводородная HI, а также кислородсодержащие серная H2SO4, хлорная HClO4, азотная HNO3 и др.
Что происходит, например, с молекулой HCl, когда она попадает в водную среду? Эта молекула – небольшой по размерам диполь: на атоме Н имеется небольшой положительный заряд; на атоме О – небольшой отрицательный (электроотрицательность кислорода заметно выше электроотрицательности водорода). Полярные молекулы Н2О, окружившие биполярную молекулу HCl, совершают хаотичные тепловые движения. В результате (через ничтожно малый промежуток времени) наступает такой момент, когда молекула HCl разрывается на части, и в растворе оказываются гидратированные ионы H+ и Cl-.
Для определения того, относится ли кислородсодержащая кислота к числу сильных электролитов или нет, существует следующее правило. Формулу любой кислоты, содержащей кислород кислоты можно записать как Э(ОН) m О n. Сила кислородсодержащей кислоты зависит только от значения n и не зависит от m. Если n ≥ 2, кислота – сильный электролит. К ним принадлежат кислоты: хлорная HClO4, хлорноватая HClO3, марганцевая HMnO4 и др.
Электролиты характеризуют по степени их диссоциации. Степень диссоциации α – это отношение числа молекул, существующих в растворе в виде гидратированных ионов, к общему числу молекул, которые существуют в растворенном веществе, или к числу формульных единиц в исходном веществе. Для сильных электролитов α = 0,8 - 1.
Устойчивые в растворах кислородсодержащие кислоты, для которых n = 1, относят к числу электролитов средней силы, значение степени диссоциации которых α лежит в пределах 0,1- 0,7. К числу таких кислот относятся: ортофосфорная кислота H3РО4, азотистая HNO2, сернистая H2SO3, уксусная CH3COOH и др.
Если для кислородсодержащей кислоты n = 1, но кислота крайне неустойчива, как например, угольная Н2СО3, то ее относят к числу слабых электролитов.
При n = 0 кислородсодержащая кислота относится к числу или неэлектролитов, или слабых электролитов. К таким кислотам принадлежат: хлорноватистая HClO, теллуровая H6TeO6, борная H3BO3 и другие аналогичные. К числу очень слабых электролитов (очень слабых кислот) относятся также следующие бескислородные кислоты: сероводородная, плавиковая, синильная и некоторые другие.
Нужно отметить, что сила кислоты и ее ядовитость никак не связаны между собой. Так, сильная соляная кислота входит в состав желудочного сока человека, а очень слабая синильная кислота – сильнейший яд.
Если в растворе протекает реакция между сильными электролитами, например, между соляной кислотой и гидроксидом натрия, которые в водных растворах существуют только в виде ионов, то очевидно, что фактически здесь происходит взаимодействие между ионами. Так, если для этой реакции
HCl + NaOH = NaCl + H2O
указать ионы, которые существуют в растворе, то можно записать следующее уравнение:
H+ + Cl - + Na+ + OH - = Na+ + Cl - + H2O
Такое уравнение называют полным ионным уравнением (или ионно-молекулярным уравнением). В таких уравнениях формулы веществ—неэлектролитов или слабых электролитов, а также веществ малорастворимых или газообразных, записывают в молекулярном виде.
Если из правой и левой частей приведенного полного ионного уравнения исключить одинаковые ионы, то получится запись:
H+ + OH - = H2O
Такую запись называют кратким ионным (ионно-молекулярным) уравнением. В данном случае эта запись будет одинаковой для всех реакций нейтрализации сильных кислот щелочами. Она показывает, что суть такой реакции – объединение ионов H+ и OH - в очень мало диссоциирующие на ионы молекулы воды.
Примером обменной реакции с участием двух растворимых солей, может служить реакция
K2SO4 + BaCl2 = BaSO4 ↓+ 2KCl
Запись полного ионного уравнения для нее имеет вид:
2K+ + SO4 2- + Ba2+ + 2Cl - = BaSO4↓+ 2K+ + 2Cl-
Краткое ионное уравнение в данном случае следующее:
SO4 2- + Ba2+ = BaSO4↓
Оно показывает, что реакция протекает за счет связывания ионов Ba2+ и SO4 2- в малорастворимое соединение BaSO4. Таким образом, при появлении в водном растворе ионов Ва2+ и SO42- наблюдается образование плохо растворимого белого осадка ВаSO4, вне зависимости от того, какую именно растворимую соль бария использовали и какой именно растворимый сульфат был взят (например, образование осадка ВаSO4 происходит при смешивании водных растворов как ВаС12 и Na2SO4, так и Ba(NO3)2 и K2SO4).
Реакции в водной среде с участием ионов протекают слева направо в направлении наиболее полного связывания ионов за счет образования плохо растворимого соединения (как в приведенном выше примере), за счет выделения газа:
СаСО3 + 2НNO3 = Ca(NO3)2 + H2O + CO2↑
СаСО3 + 2Н+ + 2NO3–= Ca2+ + 2NO3–+ H2O + CO2↑
СаСО3 + 2Н+ = Ca2+ + H2O + CO2↑; а также
или образования плохо диссоциирующего на ионы соединения типа Н2О:
NaHCO3 + NaOH = Na2CO3 + H2O
Na+ + H+ + CO32–+ Na+ + OH–= 2Na+ + CO32–+ H2O
Н++ ОН–= Н2О
Сероводород мало диссоциирует на ионы, и поэтому с соляной кислотой реагирует такое малорастворимое соединение, как сульфид железа(II) FeS:
FeS + 2HCl = FeCl2 + H2S↑
FeS + 2H+ + 2Cl–= Fe2+ + 2Cl– + H2S↑
FeS + 2H+ = Fe2+ + H2S↑
Но в случае другого сульфида – сульфида меди(II) CuS, растворимость в воде которого значительно ниже, чем FeS, реакция с участием c H2S протекает в направлении образования сульфида:
CuCl2 + H2S = CuS↓ + 2HCl
Cu2+ + 2Cl–+ H2S = CuS↓ + 2H+ + 2Cl–
Cu2+ + H2S = CuS↓ + 2H+
Могут быть и такие случаи, когда полное и краткое ионные уравнения совпадают, например:
Ba(OH)2 + H2SO4 = BaSO4↓ + 2H2O
Для этой реакции полное и краткое ионные уравнения имеют вид:
Ba2+ + 2OH–+ 2H+ + SO42– = BaSO4↓ + 2H2O
Общий вывод: реакции в растворах электролитов протекают в направлении наиболее полного связывания ионов. Если связывания нет, то и реакция не идет.
Ступенчатая диссоциация кислот. Многоосновныекислоты, в отличие от солей – сильных электролитов, диссоциируют на ионы в растворе ступенчато. Так, если первый ион Н+ от молекул серной кислоты Н2SO4 в водных растворах отщепляется практически полностью, то отщепление второго иона Н+ – это обратимый процесс:
HSO4 - ⇄ H+ + SO42-
который можно характеризовать константой равновесия (в данном случае ее называют константой кислотной диссоциации К д2):
К д2 = 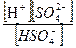
Рассмотрим ступенчатую диссоциацию такой кислоты, как ортофосфорная Н3РО4. По первой ступени диссоциации
Н3РО4 ⇄ Н+ + Н2РО4 -
ортофосфорная кислота – электролит средней силы. Для этой ступени диссоциации значение К д1 равно
К д1 = 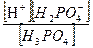
Для второй ступени диссоциации (Н2РО4 - ⇄ Н+ + НРО42-) значение К д2 равно
К д2 = 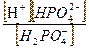
Для третьей ступени диссоциации:
Н2РО42- ⇄ Н+ + РО4 3-
значение К д3 равно
К д3= 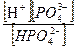
Если записать уравнение полной диссоциации ортофосфорной кислоты
Н3РО4 ⇄ 3Н+ + РО4 3- ,
то для константы полной диссоциации справедливо
β = 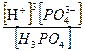
Легко видеть, что β = К д1 К д2 К д3.. Если К д1= 10-4, К д2 = 10-8, а К д3 = 10 -12, то β = 10-24.
Задание на дом
1. Напишите полные и краткие ионные уравнения, отвечающие реакциям: а) между сульфитом натрия и соляной кислотой; б) между сероводородом и нитратом меди; в) между соляной кислотой и сульфидом железа(II).
2. Укажите, будет ли протекать в водной среде реакции между: а) нитратом серебра и бромидом натрия; б) нитратом серебра и фторидом калия; в) сероводородом и хлоридом ртути(II); г) сульфидом натрия и сульфатом меди; д) сульфидом натрия и бромидом ртути(II). Там, где реакции протекают, напишите соответствующие уравнения.
3. Какая из констант, характеризующих диссоциацию на ионы сероводородной кислоты, имеет самое маленькое численное значение?
4. Объясните, почему при ступенчатой диссоциации каждая константа диссоциации, отвечающая определенной ступени диссоциации, примерно в 104 раз меньше константы, отвечающей предыдущей стадии.
5. Укажите, при каких условиях возможно протекание в водной среде реакции между нитратом натрия и хлоридом калия. Обратите внимание – за счет ее проведения наши предки превращали гигроскопичный нитрат натрия в негигроскопичный нитрат калия – компонент черного пороха.
Тема 12. Ионное произведение воды. Понятие о рН растворов. Расчет рН раствора кислоты и щелочи
Молекулы воды диссоциируют на ионы в очень небольшой степени:
Н2О ⇋ Н+ + ОН–
Этому равновесию при каждой температуре отвечает определенное значение константы равновесия К
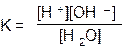
Знаменатель правой части этого уравнения — [Н2О] (молярная концентрация чистой воды, т.е. число молей воды в 1 л воды) имеет постоянное значение (1000: 18 = 55,6). Следовательно, и произведение молярных концентраций ионов Н+и ОН–, образующихся при диссоциации молекул воды, [Н+]•[ОН–] = К •[Н2О] при фиксированной температуре для любых (кислых, нейтральных и щелочных) водных растворов — величина постоянная. Это произведение называют ионным произведением воды (принятые обозначения ИП или Кw); Кw =[Н+]•[ОН–]). Размерность ИП или Кw моль2/л2, но ее обычно опускают.
Сказанное справедливо для относительно разбавленных водных растворов, т.е. для растворов, в которых концентрация кислоты или щелочи не выше 0,1 моль/л. Экспериментально найдено, что значение ИП воды при 22°С равно Кw = 10-14. Диссоциация воды на ионы — эндотермический процесс, и с ростом температуры наблюдается увеличение значения Кw.
Из того, что Кw = [Н+]•[ОН–] = 10-14, следует, что в нейтральном растворе, когда [Н+] = [ОН–], молярные концентрации ионов [Н+] = [ОН–] = 10-7 моль/л.
Рассмотрим теперь случай, когда в воде находится соляная кислота HCl с молярной концентрацией 1•10-3 моль/л. В этом растворе кислая среда. Концентрация ионов [Н+] = 1•10-3 моль/л (соляная кислота — сильный электролит, и в растворе находится только в виде гидратированных ионов). При нахождении концентрации [Н+] дополнительным образованием ионов Н+ за счет диссоциации молекул воды можно пренебречь, так как присутствие соляной кислоты подавляет диссоциацию молекул воды.
Если же взять водный раствор щелочи — гидроксида калия КОН с молярной концентрацией, равной, например, 10-2 моль/л, то молярная концентрация ионов ОН- в этом случае будет также равна [ОН–] = 10-2 моль/л (сильный электролит КОН в растворе, как и НСl, существует только в виде ионов). Но и этот щелочной раствор можно охарактеризовать через концентрацию в нем ионов [H+]. С учетом ИП воды концентрация в нем [H+] = 10-14/10-2 = 10-12 моль/л.
Таким образом, любой раствор — и кислый, и нейтральный, и щелочной можно охарактеризовать через молярную концентрацию ионов Н+. В кислом растворе [H+]> 10-7 моль/л, в щелочном растворе – [H+] < 10-7 моль/л.
Для того чтобы при характеристике среды любых растворов через концентрацию ионов H+ не использовать выражения с отрицательными степенями (при широком применении это не очень удобно), решили указывать не само значение молярной концентрации ионов Н+, а десятичный логарифм этого значения, взятый с обратным знаком. Эту характеристику среды водного раствора обозначают как рН (пэ аш). Для нейтрального раствора значение рН = – lg[H+] = – lg[10-7] = 7. Для кислых растворов значение рН меньше 7, а для щелочных растворов – больше 7. Так, в случае раствора 10-3 моль/л HCl рН = – lg[H+] = – lg[10-3] = 3, а в случае раствора 10-2 моль/л КОН, для которого [H+] = 10-12, рН = – lg[H+] = – lg[10-12] = 12.
Довольно часто вместо использования термина «рН раствора» используют термин «водородный показатель». Он подчеркивает, что любой раствор – и кислый, и нейтральный, и щелочной может быть охарактеризован через концентрацию ионов Н+.
Так как значение Кw с ростом температуры возрастает (при нагревании увеличивается диссоциация молекул Н2О на ионы), то и значение рН нейтрального водного раствора с ростом температуры изменяется (оно уменьшается, так как сама концентрация ионов Н+ при этом растет).
Значения рН широко используют в химии, биохимии, геохимии, медицине, при разработке различных косметических препаратов и т.д. Так, рН желудочного сока человека 2-4, рН крови около 8 и т.д.
Для определения рН растворов используют индикаторную бумагу. В центральную часть небольшой полоски такой бумаги помещают каплю испытуемого раствора и сравнивают окраску этой части бумаги с цветовой шкалой, по которой и находят значение рН раствора. В лабораториях для точного определения рН применяют и специальные электронные приборы – рН-метры. В школьной практике для определения характера среды в растворе используют растворы особых веществ – индикаторов. Наиболее популярны в школьном кабинете химии растворы лакмуса, метилоранжа и фенолфталеина. Лакмус – это вещество растительного происхождения, содержащее несколько органических соединений. В кислой среде раствор лакмуса красный, в щелочной – синий, в нейтральной – фиолетовый. Окраска лакмуса к изменению среды мало чувствительна, поэтому лакмус используют только в школьной практике. В щелочной среде (при рН, немногим выше 7) раствор фенолфталеина красный, в нейтральной или кислой – бесцветный. Раствор метилоранжа в кислой среде – красный, в щелочной – оранжевый. На практике также часто используют полоски, содержащие так называемый универсальный индикатор. Ели эту полоску смочить каплей исследуемого раствора и затем сравнить возникшую окраску полоски с шкалой зависимости цвета плоски от рН, то в интервале рН 1-13 его значение можно определить с погрешностью примерно в 1 единицу рН.
Понятие рН можно использовать для растворов, в которых концентрация ионов Н+ или ОН– меньше примерно 0,1 моль/л. Для растворов с более высокими значениями молярных концентраций этих ионов значение Кw не остается постоянно равным 10-14, и характеризовать такие растворы через рН нельзя. Такие растворы характеризуют через молярную концентрацию соответствующей кислоты или щелочи. Нужно отметить, что встречающиеся иногда в учебных пособиях вопросы и ответы к ним типа: «Каково значение рН 1 моль/л раствора HCl? (рекомендуемый как правильный ответ рН = 0)» или ««Каково значение рН 5 моль/л раствора серной кислоты? (рекомендуемый как правильный ответ рН = –1)» некорректны. Понятие рН применимо только к водным разбавленным растворам. Для характеристики кислотности (щелочности) концентрированных растворов следует использовать понятие «молярная концентрация ионов Н+».
|
|
|
|
|
Дата добавления: 2015-01-03; Просмотров: 471; Нарушение авторских прав?; Мы поможем в написании вашей работы!