
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Задачи на дом 1 страница
|
|
|
|
1. Во сколько раз различаются энергии электрона, отвечающие: а) n =1 и n =2, б) n =4 и n =5, в) n =10 и n =11?
2. Какова масса всех электронов, имеющихся в 1 л воды?
3. Какие физические свойства есть у вещества, состоящего только из электронов?
Задачи на массовую долю вещества в растворе
1. Сколько граммов LiOH надо добавить к 500 г воды, чтобы получить 3%-й раствор?
2. Сколько граммов Li2O надо добавить к 500 г воды, чтобы получить 3%-й раствор?
3. Сколько граммов лития надо добавить к 500 г воды, чтобы получить 3%-й раствор?
4. Сколько граммов СаСО3 надо добавить к 200 г 20%-й соляной кислоты, чтобы получить 15%-й раствор соляной кислоты?
5. Сколько граммов К2СО3 надо добавить к 200 г 20%-й соляной кислоты, чтобы получить 5%-й раствор: а) соляной кислоты, б) карбоната калия, в) хлорида калия?
Тема 3. Электронные оболочки многоэлектронных атомов. Главное, побочное и магнитное квантовые числа. Спин электрона. Принцип В.Паули.
Для многоэлектронных систем найти точное решение уравнения Шрёдингера нельзя. Анализ приближенных решений этого уравнения для многоэлектронных атомов и их сопоставление с результатами спектроскопических экспериментов показали, что состояние электрона в таких атомах (прежде всего – его энергию) можно охарактеризовать тремя так называемыми квантовыми числами.
То, что чисел три, можно отдаленно рассматривать как аналогию с тремя координатами, характеризующими перемещение материальной точки в пространстве. Термин «квантовые» в данном случае означает, что изменение энергии электрона в атоме происходит не плавно, а скачками, увеличиваясь или уменьшаясь сразу на определенную порцию – квант энергии.
Эти три числа называют: главное, побочное и магнитное квантовое число и обозначают латинскими буквами n, l и m соответственно.
Главное квантовое число n – это основная характеристика энергии электрона в атоме. Как уже говорилось, значение n может быть равно любому целому числу (1, 2, 3, 4, 5 и т.д.). Принято обозначать значение n =1 латинской буквой K, значение n =2 – буквой L, значение n = 3 – буквой M, значение n = 4 – буквой N и т.д.
Совокупность электронов в атоме с одинаковым значением значение главного квантового числа n образуют электронную оболочку (электронный слой). Электроны, для которых значение n = 1, образуют К -оболочку; электроны, для которых значение n = 2, L -оболочку и т.д.
Общее число электронных оболочек в невозбужденном атоме, как правило, равно номеру периода, в котором атом расположен в периодической системе (исключение – атом пятого периода палладий Pd, у которого в невозбужденном состоянии заполнены электронами четыре оболочки).
Энергия электронов, принадлежащих к какой-либо одной оболочке, может различаться. Эти различия передает побочное квантовое число l. Как показывает квантово-химический анализ, при данном значении главного квантового числа n целочисленные значения l могут изменяться от 0 до n -1. Например, при n = 3 значения l могут быть равны 0, 1 или 2. Если l= 0, то говорят о s –электронах; если l = 1, то о p - электронах; если l = 2, то о d -электронах; если l = 3, то о f -электронах и т.д. Число возможных различных значений l при данном значении n равно n. Например, при n = 3 возможные значения l = 0, 1 или 2, и всего их 3.
Электроны в атоме с одинаковыми значениями n и l образуют энергетический подуровень (другие возможные названия – энергетический уровень, электронный подуровень).
При определенных условиях проявляются более тонкие отличия в энергии электронов с определенным значением побочного квантового числа l. Эти различия характеризуют через значение магнитного квантового числа m. При данном l возможные значения m лежат в пределах от – l до + l через 0. Так, при l = 2 возможные значения m составляют -2, -1, 0, 1 и 2. При данном l число возможных различных значений m равно 2 l + l. Так, при l = 2 число возможных различных значений m равно 2·2 + l =5.
Электроны в атоме с определенными значениями трех квантовых чисел n, l и m образуют электронную орбиталь. Иногда каждую орбиталь рассматривают как «ячейку» электронной оболочки данного атома. Часто такую ячейку условно изображают в виде небольшого прямоугольника или горизонтальной черты (рис.1).
Для s –уровня (подуровня) число орбиталей равно 1, для p -уровня равно 3, для d -уровня – 5 и т.д. Общее число электронных орбиталей на оболочке с номером n равно n2. В том, что это действительно так, можно

Рис.1.Схематичное изображение электронной орбитали, содержащей
два спаренных электрона
убедиться методом математической индукции. При этом надо учесть возможные значения при данном n побочного и магнитного квантовых чисел.
Исследования показали, что электрон обладает и еще одной, четвертой квантовой характеристикой – спином (условное обозначение s). Значение спина может быть равно +½ или –½. Для обозначения спина используют вертикальные стрелки: ↑ (отвечает значению спина +½) и ↓ (отвечает значению –½). На одной орбитали может находиться максимум два электрона с противоположными значениями спина, так что суммарный спин электронов на этой орбитали равен 0. Про такие электроны говорят, что они спарены. Число неспаренных электронов в атоме (и в молекуле) можно довольно просто определить экспериментально. Так, экспериментально показано, что в одной молекуле газа кислорода О2 имеется 2 неспаренных электрона, и спин молекулы равен +½ + ½ = 1.
Заполнение электронных оболочек происходит в соответствии с принципом минимальной энергии электронной оболочки (каждый новый электрон поступает в атом на то место, где энергия электрона минимальна) и принципом В.Паули. Принцип Паули гласит, что в одном атоме не может быть двух электронов, у которых все 4 квантовых числа (главное, побочное, магнитное и спиновое) были бы одинаковы.
Задание на дом
1. Выучите определения электронной оболочки, энергетического уровня, орбитали. Какой смысл может иметь термин «электронная оболочка атома»?
2. Какие значения могут принимать главное, побочное, магнитное и спиновое квантовые числа?
3. Какие электроны называют спаренными?
4. Что такое принцип Паули?
Задачи на массовую долю вещества в растворе
1. Сколько литров хлороводорода (н.у.) надо дополнительно растворить в 300 г 20%-го раствора соляной кислоты, чтобы массовая доля раствора стала 25%?
2. Какова массовая доля сероводорода в растворе, если 3 л сероводорода (н.у.) растворить в 1 л воды?
3. Сколько граммов кристаллогидрата CuSO4 · H2O надо добавить к 200г 3%-го раствора сульфата меди, чтобы получить 5%-й раствор?
4. Сколько граммов нитрата серебра надо добавить к 400 г 6%-го раствора хлорида калия, чтобы получить 3%-й раствор хлорида калия?
5. Сколько граммов оксида серы(VI) надо добавить к 500 г 40%-го раствора серной кислоты, чтобы получить 60%-ю кислоту?
Тема 4. Форма электронных облаков. Электронные конфигурации атомов. Периодическая система элементов Д.И.Менделеева и порядок заполнения электронами электронных оболочек атомов. Правило Гунда (Хунда).
Значения квантовых чисел n и l определяют как энергию соответствующих электронов в атоме, так и форму области пространства, в котором наиболее вероятно нахождение электрона (максимальна плотность электронного облака).
Значение n прежде всего отражается на протяженности электронного облака. Чем больше n, тем дальше от ядра существует заметная плотность облака, отвечающего данному электрону (хотя увеличение объема этой области с ростом n сравнительно невелико). На форме электронного облака сказывается главным образом значение побочного квантового числа l. Так, если l = 0, т.е. речь идет об s- электронах, то облако имеет сферическую форму (рис.2, а). s- Облако имеет центральную симметрию. Интересно следующее. Если на s- орбитали находится только один неспаренный электрон, то объем (и радиус сферы, отвечающей основной плотности этого облака) заметно больше, чем объем орбитали, на которой расположены два спаренных электрона. Появление второго электрона приводит к уменьшению объема соответствующего сферического облака на 25-30% и больше.

а б
Рис. 2. Условное изображение s -электронного облака (а) и
р -электронного облака (б)
Если речь идет о p -электронах (l = 1), то облако имеет не центральную, а осевую симметрию. Таких электронных облаков 3. Приближенно каждое такое облако можно представить себе как состоящее из двух симметричных частей (как две свеклы с длинными хвостиками, соединенные между собой в тех местах, где была удалена ботва).
p -Электроны располагаются на трех взаимно перпендикулярных осях, проходящих через центр ядра атома (рис. 2, б). Эти оси можно обозначить как x, y и z. Соответственно, сами облака можно обозначить как px, py и pz (рис. 3). Каждое электронное облако может включать электронную плотность, отвечающую двум электронам с разными значениями спина s (s = +½ и -½).
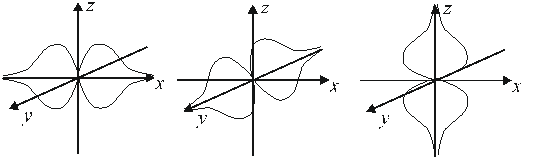
Рис. 3. Три р -орбитали, расположенные в пространстве взаимно перпендикулярно, можно рассматривать как отвечающие трем координатным осям х, у и z
Каждое p- облако имеет две части, расположенные по разные стороны от центра ядра атома (в том числе и тогда, когда на этой орбитали находится только один неспаренный электрон). Приближенно каждое такое облако можно представить себе как две свеклы с длинными хвостиками, соединенные между собой в тех местах, где была удалена ботва.
В случае l = 2 или 3 (т.е. d- или f- электронов) форма облаков (соответственно пяти или семи) еще более сложная и здесь рассматриваться не будет.
При последовательном заполнении электронами электронных оболочек и подоболочек (подуровней) электроны сначала поступают в атоме на те орбитали, где их энергия минимальна (т.е. электроны наиболее прочно связаны с ядром). Особенности изменения энергии электронов по мере заполнения электронной оболочки атомов показаны на рис. 4.
Сначала электроны попадают на самый низший уровень 1 s. Когда он полностью заполняется, новые электроны начинают поступать на уровень с большей энергией 2 s, потом – на уровень 2 p, затем – на 3 s и далее на 3 p. Уровень 3 d по энергии оказывается более высоким, чем 4 s, поэтому очередной электрон сначала попадает на уровень 4 s, а только потом на уровень 3 d и т.д., как это показано на рис. 4.

Рис.4. Энергетическая диаграмма заполнения электронами орбиталей 1-4 электронных слоев
Из-за того, что значение главного квантового числа в квадрате n2 входит в выражение для энергии электрона в знаменатель, различия в энергии электронов с разными значениями главного квантового числа n, отвечающие электронным оболочкам с n и n+1 (значения разности En – En+1), быстро уменьшаются по мере роста n. Это сближение условно отражено на рис. 4.
Руководствуясь приведенными выше сведениями о квантовых числах и порядке заполнения электронами атомов химических элементов, можно построить периодическую систему элементов. Удивительно, что Д.И.Менделеев, ничего не зная о квантовых числах, уровнях, подуровнях и других характеристиках электрона и электронных оболочек атомов, смог на основании гениальной интуиции создать более 150 лет назад периодическую систему элементов!
В атоме водорода H (атомный номер Z = 1) первый электрон попадает на уровень 1 s (рис. 5). В атоме гелия Не (Z = 2) новый электрон попадает
| 1s | 2s | 2p | |
| 1Н | 
| ||
| 2Не | 
| ||
| 3Li | 
| 
| |
| 3Be | 
| 
| |
| 5B | 
| 
| 
|
| 6C | 
| 
| 
|
| 7N | 
| 
| 
|
| 8O | 
| 
| 
|
| 9F | 
| 
| 
|
| 10Ne | 
| 
| 
|
Рис.5. Заполнение электронами орбиталей элементов от H до Ne
также на уровень 1 s. У одного из двух электронов атома гелия набор квантовых чисел такой: n = 1, l = 0, m = 0, s = ½; а у второго – n = 1, l = 0, m =0, s = –½. В атоме следующего за гелием элемента лития Li (Z = 3) три электрона. Однако третьему электрону места в оболочке с n = 1 нет: квантовые характеристики третьего электрона в этой оболочке будут полностью совпадать с характеристиками одного из двух уже имеющихся здесь электронов. А такое совпадение невозможно, оно запрещено принципом Паули. Поэтому третий электрон атома лития занимает место на второй электронной оболочке, так что у него n = 2. Остальные его квантовые характеристики следующие: l = 0, m = 0, s = ½.
Для того, чтобы отразить характер заполнения электронами какого-либо атома, используют не пространные записи типа приведенных выше, а так называемые электронные конфигурации атомов. В случае атома лития электронная конфигурация нейтрального невозбужденного атома имеет вид: 1 s 22 s 1 (нужно отметить, что и во всех остальных случаях в этом разделе речь идет об описании электронных конфигураций именно нейтральных невозбужденных атомов).
На орбитали 2 s могут находиться (в соответствии с принципом Паули) 2 электрона (с разными значениями спина). Поэтому понятно, что электронная конфигурация следующего за литием в периодической системе элемента бериллия Ве (Z = 4) 1 s 22 s 2.
В атоме бериллия все места для электронов на 2 s- подуровне заняты. Новый, пятый электрон у атома следующего за бериллием элемента бора В (Z = 5) поступает на орбиталь, для которой n = 2, значение побочного квантового числа l = 1, магнитного m = 0, а спин s = ½. Орбиталь с l = 1 – это орбиталь р- электрона. Всего таких орбиталей 3. Электронная конфигурация атома бора 1 s 22 s 22 р 1.
В атоме следующего за бором элемента – углерода С (Z = 6) шесть электронов. Шестой электрон может попасть на 2 р- орбиталь, где уже имеется один электрон со спином s = +½, а может – и на свободную 2 р- орбиталь, где еще нет электрона. В соответствии с правилом, Гунда (фамилию сейчас часто пишут через первую букву «х»: Хунд) в пределах одного подуровня электроны располагаются так, чтобы их суммарный спин был максимален. Иными словами, правило Гунда – правило максимальной мультиплетности спина, т.е. максимального сложения значений спина электронов данного подуровня.
Поэтому первый электрон, оказавшийся на орбитали, всегда имеет спин + ½ и правильно изображается стрелкой, направленной вверх (↑). Новый шестой электрон в атоме углерода попадает на свободную 2 р -орбиталь со спином + ½. В результате на двух р -орбиталях атома С оказывается по одному р -электрону, и их суммарный спин оказывается равен ½ +½ = 1 (если бы шестой электрон в атоме С занял место на орбитали, где уже был электрон со спином ½, суммарный спин этих двух электронов стал бы равен 0). Таким образом, электронная конфигурация атома С 1 s 22 s 22 р 2.
С учетом правила Гунда новый электрон в атоме элемента азота N (Z = 7) попадает на третью свободную р -орбиталь второго подуровня. Электронная конфигурация атома N 1 s 22 s 22 р 3, а суммарный спин атома равен 1,5 (3·. ½).
В атоме следующего за азотом элемента кислорода О (Z = 8) свободных р -орбиталей нет, и восьмой электрон занимает место на одной из этих орбиталей, где уже был неспаренный электрон. Спин нового электрона –½, а суммарный спин атома кислорода ½ + ½ = 1. Электронная конфигурация атома кислорода О 1 s 22 s 22 р 4.
Понятно, что в атоме фтора F (Z = 9) остается только один неспаренный электрон со спином ½. Электронная конфигурация этого атома 1 s 22 s 22 р 5.
В атоме замыкающего второй период элемента неона Ne (Z = 10) все электроны 2 р -подуровня спарены. Суммарный спин атома неона 0, а его электронная конфигурация 1 s 22 s 22 р 6. Теперь все места на уровне с главным квантовым числом n = 2 заняты, и в соответствии с принципом Паули одиннадцатый электрон в атоме следующего в периодической системе за неоном элемента натрия Na (Z = 11) занимает место на 3 s- орбитали следующего электронного слоя с n = 3. Электронная конфигурация атома натрия 1 s 22 s 22 р 63 s 1, его спин ½.
У последующих элементов от магния Mg (Z = 12) до аргона Ar (Z = 18) порядок заполнения электронами 3 s- и 3 р- подуровней аналогичен порядку заполнения 2 s- и 2 р- подуровней второго электронного слоя. Электронная конфигурация аргона Ar 1 s 22 s 22 р 63 s 23 р 6.
Уже отмечалось, что координата электрона в атоме не определена, и указать, какой электрон ближе к ядру, а какой дальше, нельзя. Тем не менее, в литературе устоялись идущие от доволновых представлений о природе электрона выражения типа «внешний электронный слой», «предвнешний электронный слой» и аналогичные. В рамках таких представлений электронный слой атома с максимальным для его электронов значением главного квантового числа называют внешним. Если использовать этот термин, то можно сказать, что внешние электронные слои атомов аргона и неона характеризуются одинаковой конфигурацией s 2 р 6.
Как следует из приведенной на рис. 4 диаграммы, энергия электронов 4 s –подуровня в атоме меньше, чем 3 d -подуровня. Поэтому новый, девятнадцатый электрон в атоме калия K (Z = 19) поступает не на 3 d -подуровень, который имеется в слое с главным квантовым числом n = 3, а на 4 s -подуровень следующего электронного слоя с главным квантовым числом n = 4. Поэтому электронная конфигурация атома калия 1 s 22 s 22 р 63 s 23 р 64 s 1. Электронная конфигурация следующего за калием в периодической системе элемента кальция Са (Z = 20) 1 s 22 s 22 р 63 s 23 р 64 s 2.
В атоме кальция оба места на 4 s -орбитали электронами заняты. Энергия 3 d -подуровня ниже, чем 4 p (рис. 4). Поэтому, если атомный номер элемента увеличится еще на единицу, то новый двадцать первый электрон в атоме элемента скандия Sc (Z = 21) попадет на одно из вакантных мест на 3 d –подуровне, состоящего из пяти орбиталей (рис. 6).
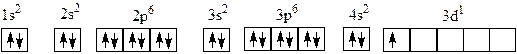
Рис.6. Схема заполнения электронами орбиталей в атоме скандия
Заполнение электронами 3 d –подуровня в атомах двух следующих элементов – титана Ti (Z = 22) и ванадия V (Z = 23) происходит в соответствии с приведенными выше принципами и правилами. В результате в атоме ванадия на 3 d –подуровне оказывается три неспаренных электрона (электронная конфигурация атома ванадия 1 s 22 s 22 р 63 s 23 р 63 d 34 s 2) и приводит к тому, что в этом атоме три неспаренных электрона.
Обратите внимание! Хотя по энергии 3 d –электроны выше, чем 4 s- электронов, и попали они в соответствующие атомы уже тогда, когда 4 s- электроны в их оболочке уже были, при указании электронной конфигурации 4 s- электроны записывают после 3 d –электронов.
Казалось бы, электронная конфигурация атома хрома Cr (Z = 24) будет 1 s 22 s 22 р 63 s 23 р 63 d 44 s 2 и спин атома хрома 2 (4· ½). Но на самом деле спин этого атома 3 (6·½). Откуда же в атоме хрома 6 неспаренных электронов? Дело в том, что состояние с наполовину заполненным электронами 3 d- подуровне (по одному электрону на каждой из пяти 3 d- орбиталей) и одним электроном на 4 s -подуровне энергетически более выгодно (т.е. обладает меньшей энергией), чем распределение электронов, отвечающее конфигурации 1 s 22 s 22 р 63 s 23 р 63 d 44 s 2.
В атоме хрома Cr один электрон с 4 s- орбитали как бы «проваливается» и попадает на свободную 3 d- орбиталь. Поэтому правильно записанная
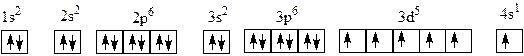
Рис. 7. Схема заполнения электронами орбиталей в атоме хрома
электронная конфигурация нейтрального невозбужденного атома хрома 1 s 22 s 22 р 63 s 23 р 63 d 54 s 1. В атоме хрома 6 неспаренных электронов (пять на 3 d 5 и один на 4 s 1). Поэтому суммарный спин атома хрома равен 3. Численное значение спина хрома самое большое для атомов 4-го периода.
Далее сначала происходит заполнение 4 s –подуровня (электронная конфигурация атома марганца Mn, для которого Z = 25, 1 s 22 s 22 р 63 s 23 р 63 d 54 s 1). Затем наблюдается дозаполнение (достройка) 3 d- подуровня.
Электронная конфигурация атома меди Cu, Z = 29, 1 s 22 s 22 р 63 s 23 р 63 d 104 s 1, а атома цинка Zn, Z = 30, 1 s 22 s 22 р 63 s 23 р 63 d 104 s 2. Далее с ростом атомного номера элемента до Z = 38 у криптона Kr происходит постепенное заполнение электронами 4 р -подуровня. Последующее заполнение электронами слоев и подуровней в атомах происходит в соответствии с указанными выше принципами и правилами. Заполнение электронами 4 f –подуровня, который имеется в 4-м электроном слое, начинается у элементов не 5-го, а 6-го периода, после того, как на 6 s -подуровне электронных оболочек атомов этого периода оказывается 2 электрона. В результате такой особенности заполнения в 6-м периоде оказывается 14 близких по химическим свойствам элементов – лантаноидов (на орбиталях 4 f –подуровня всего может разместиться 7·2 = 14 электронов).
Обратите внимание: во всех рассмотренных случаях внешний электронный слой атома содержит не больше 8 электронов.
Задание на дом
1. Запишите в тетради электронные конфигурации атомов всех элементов 4-го периода. Каково значение суммарного спина каждого из этих атомов?
2. У атомов какого элемента 4-го периода самое большое значение спина?
3. Какому элементу отвечает электронная конфигурация 1 s 22 s 22 р 63 s 23 р 63 d 64 s 2?
Задачи на массовую долю вещества в растворе
1. Сколько граммов цинка надо добавить к 200 мл 30%-й соляной кислоты (плотность 1,15 г/см3), чтобы получить: а) 25%-й раствор соляной кислоты; б) 5%-й раствор хлорида цинка?
2. Сколько граммов ВаСl2 ·2H2O надо внести в 300 г 25%-го раствора серной кислоты, чтобы получить: а) 20%-й раствор серной кислоты; б) 5%-й раствор соляной кислоты; в) 5%-й раствор хлорида бария?
Тема 5. Электроотрицательность. Ван-дер-ваальсова (физическая) связь и химическая связь.
Ионный вид химической связи.
Атомы способны взаимодействовать между собой. При этом между ними возникают связи, которые могут быть довольно слабыми, а могут быть и сильными, очень прочными. Взаимодействие между атомами определяется характеристиками содержащихся в них электронов.
Слабые взаимодействия между атомами приводят, например, к тому, что поверхность нашей одежды, поверхность стен, волосы и т.д. поглощают различные вещества, в том числе и пахучие. С течением времени связи поглощенных веществ с поверхностью разрушаются. Такую непрочную связь принято называть ван-дер-ваальсовой связью (по имени впервые описавшего этот тип связи голландского физика Я.-И.Ван-дер-Ваальса). Эта связь обусловлена чисто физическими взаимодействиями, поэтому ее можно назвать физической связью.
Более прочную связь между атомами рассматривают как химическую связь. Возникновение такой связи между атомами может быть обусловлено тем, что атомы разных элементов различаются по способности отдавать электроны и принимать в свою электронную оболочку электроны других атомов. Одним из первых на различия в этой способности у атомов разных элементов обратил внимание Л.Полинг, который ввел в обиход специальную характеристику атомов – значение их электроотрицательности (ЭО). Он создал первую шкалу ЭО, в которой атомам разных элементов приписано определенное ее численное значение (в относительных единицах, размерности у значений ЭО нет).
Наибольшей способностью отдавать при взаимодействии с атомами других элементов свой электрон обладают атомы 1-й группы периодической системы – атомы щелочных элементов. Л.Полинг приписал атомам самого легкого щелочного элемента – лития Li значение ЭО, равное 1. У других щелочных элементов оно может быть немного меньше 1 (например, у цезия Cs оно равно 0,7). Для разных элементов-металлов значение ЭО по Полингу может быть от 0,7 до 2,5.
|
|
|
|
|
Дата добавления: 2015-01-03; Просмотров: 1093; Нарушение авторских прав?; Мы поможем в написании вашей работы!