
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Задачи на дом 6 страница
|
|
|
|
Кислоты получают следующими основными способами:
1. Взаимодействием кислотных оксидов с водой:
SO3 + H2O = H2SO4.
2. Взаимодействием солей и кислот:
H2SO4 + BaBr2 = BaSO4↓ + 2HBr.
3. Гидролизом некоторых соединений:
PI3+ 3H2O = H3PO3 + 3HI.↑
4. Некоторые бескислородные кислоты — взаимодействием соответствующих простых веществ:
Н2 + С12 = 2НС1; Н2 + S ⇄ H2S.
5. Органические кислоты часто получают окислением соответствующих альдегидов:
CH3COH + Ag2O = CH3COOH + 2Ag.
Для определения наличия кислот в водных растворах используют индикаторы – вещества, окраска которых изменяется в зависимости от характера среды раствора (кислой, нейтральной или щелочной).
Сложные вещества, при растворении в воде (как бы мала сама по себе эта растворимость ни была) диссоциирующие с образованием из анионов только гидроксид-ионов ОН–, называют основаниями. К числу оснований принадлежат: гидроксид калия КОН, гидроксид бария Ва(ОН)2, гидроксид лантана La(OH)3 и др.
В соответствии с представлениями, развитыми датским ученым Й.Н.Бренстедом, кислоты – это доноры протона Н+ (иона Н+), а основания — это акцепторы протона:
НCl + KOH = KCl + H2O
кислота основание
или
Н+ + ОН– = Н2О,
кислота основание
или, с учетом того, что ион Н+ присоединяется к молекуле воды и входит в состав иона гидроксония H3O+:
Н3О+ + ОН– = Н2О + Н2О
кислота 1 основание 1 кислота 2 основание 2
В рамках представлений Брёнстеда аммиак NH3 – основание, так как молекула аммиака способна присоединить ион Н+, превращаясь в ион аммония.
По представлениям американского химика Г.Р.Льюиса, кислоты – это акцепторы электронной пары, а основания — это доноры электронной пары, например:
Н+ + ОН– = Н2О
и также:
ВF3 + HF = H[BF4].
кислота Льюиса основание Льюиса
В школьном курсе химии, когда говорят об основаниях, обычно имеют в виду соединения, подпадающие под первое из приведенных выше определений (т.е. соединения, при растворении в воде образующие из анионов только ионы ОН–).
Основания, в зависимости от числа содержащихся в их составе групп ОН, которые могут быть замещены на анионы кислотных остатков, иногда подразделяют на однокислотные (NaOH, RbOH и др.), двухкислотные [Са(ОН)2, Ва(ОН)2 и др.) и более кислотные [La(OH)3 и др.], но эти термины используют редко.
Растворимые в воде основания называют щелочами. К числу щелочей принадлежат гидроксид калия КОН, гидроксид бария Ва(ОН)2 и др. Щелочи — сильные электролиты, в водных растворах они полностью диссоциированы на ионы:
Ва(ОН)2 = Ва2+ + 2ОН–.
Нерастворимые в воде основания – слабые электролиты. Это, например, гидроксид меди(II) Сu(OH)2, гидроксид кобальта(II) Co(OH)2,гидроксид никеля(II) Ni(OH)2, гидроксид алюминия Al(OH)3 и др.
Типичные реакции оснований следующие:
1. Взаимодействие с кислотами (реакция нейтрализации):
Ba(OH)2 +2CH3COOH = Ba(CH3COO)2 + 2H2O.
2. Взаимодействие с кислотными и амфотерными оксидами:
Ca(OH)2 +2CO2 = Ca(HCO3)2,
2NaOH +ZnO + H2O = Na2[Zn(OH)4].
3. Взаимодействие с солями, если при реакции образуется новое нерастворимое или неустойчивое в растворе вещество:
NH4С1 + NaOH = NaCl + NH3↑ + H2O.
4. При нагревании многие основания разлагаются на соответствующий оксид и воду:
2Fe(OH)3 t = Fe2O3 + 3H2O↑
Следует иметь в виду, что основания щелочных элементов термически устойчивы и при нагревании не разлагаются.
Важнейшие способы получения оснований следующие:
1. Взаимодействием активных металлов или их оксидов с водой:
2Li + 2H2O = 2LiOH + H2↑; CаО + H2O = Са(ОН)2.
2. Взаимодействием растворов щелочей и солей менее активных, чем щелочные, металлов:
MgSO4 + 2NaOH = Mg(OH)2↓ + Na2SO4.
3. При электролизе водных растворов солей щелочных элементов (о электролизе см. далее, в теме 18):
2NaCl + 2H2O = 2NaOH + H2↑ + Cl2↑.
4. При добавлении раствора аммиака NH3 к растворам некоторых солей:
FeCl3 +3NH3 +3H2O = Fe(OH)3↓ + 3NH4Cl.
5. Иногда — при приливании раствора карбоната (например, соды Na2CO3), сульфида (например, сульфида калия K2S) или другого сходного реагента к раствору соли металла (если при этом соответствующий карбонат или сульфид данного металла немедленно полностью разлагается водой):
3Na2CO3 + 2AlCl3 + 3H2O = 2Al(OH)3↓ + 3CO2↑ + 6NaCl.
Такие реакции уже обсуждались в теме 13 «Гидролиз солей».
Сложные вещества, в состав которых входят катионы металлов или ион аммония NH4+ и кислотный остаток, называют солями. К числу солей относятся сульфат алюминия Al2(SO4)3, фторид натрия NaF, ацетат кальция Ca(CH3COO)2, моногидрофосфат аммония (NH4)2HPO4 и многие другие. Можно дать и такое определение термина «соль»: соли – это вещества, образующиеся при взаимодействии кислот и оснований.
Соли подразделяют на средние, кислые и основные. В составе средних солей нет ни атомов Н, которые можно заместить на катионы металлов, ни групп ОН, которые можно заместить на кислотные остатки. Примеры средних солей: NaCl, K2CO3, (NH4)2SO4, Ca3(PO4)3.
В составе кислых солей, кроме катионов металла или иона аммония, входят катионы Н+: NaHCO3, KHF2, NH4HSO4, Ca(H2PO4)2 и др. Кислые соли можно рассматривать как продукт неполной нейтрализации кислот. К числу кислых солей относят только те соединения, в состав которых входят атомы водорода, которые можно заместить на катионы металла или ион аммония. Если соль содержит атомы Н, которые к такому замещению неспособны, то соль рассматривают как среднюю. Например, не относятся к числу кислых такие соли, как Na2HPO3, CH3COONa и др.
Осн о вные соли (правильное ударение на второй гласной о) – это соли, которые в своем составе, кроме кислотного остатка, содержат гидроксогруппу ОН: Cu2(OH)2CO3, ZnOHCl и др.
Можно отметить, что, как правило, растворимость в воде кислых солей выше, чем средних, а основных – значительно ниже, чем средних.
Важную основу классификации солей составляет их отношение к воде. По этому признаку соли можно подразделить, во-первых, на разлагающиеся под действием воды (Al2S3 и др.) и водой неразлагающиеся (ZnS, KCl, Na3PO4, Ba(NO3)2 и др.).
Устойчивые в водной среде соли обычно подразделяют на хорошо растворимые в воде (растворимость при комнатной температуре составляет 5 - 10 г и более в 100 г воды), средне растворимые (растворимость составляет от нескольких десятых долей грамма до 5 – 10 г в 100 г воды), мало растворимые (растворимость менее десятых долей грамма, но больше тысячных грамма в 100 г воды) и практически нерастворимые (растворимость в 100 г воды менее тысячной доли грамма). Некоторых солей, например, Ca(NO3)2, в 100 г воды при комнатной температуре можно растворить более 100 г. Существует и такая соль, как HgS с растворимостью в воде, близкой к 0 (расчет показывает, что одна группа HgS приходится в растворе в среднем на 1 м3 воды).
Большинство солей – сильные электролиты. Наиболее сильные электролиты – перхлораты натрия NaClO4 и калия KClO4. Но известны и соли, существующие в водной среде в недиссоциированном на ионы виде (например, HgCl2).
Типичные реакции с участием солей следующие:
1. Взаимодействие солей с кислотами, например:
BaCl2 + H2SO4 = BaSO4↓+ 2HCl.
2. Взаимодействие солей со щелочами, например:
MgCl2 + 2NaOH = Mg(OH)2↓+ 2NaCl.
3. Взаимодействие солей с другими солями:
Na2SO4 + BaCl2 = BaSO4↓+ 2NaCl.
4. Взаимодействие солей с металлами:
CuSO4 + Fe = FeSO4 + Cu.
5. Взаимодействие солей при нагревании с некоторыми оксидами:
2Na2CO3 + SiO2 t = Na4SiO4 + 2CO2↑.
6. Многие соли при нагревании разлагаются, например
2LiNO3 t = 2LiNO2 + O2↑.
Важнейшие способы получения солей:
1. Взаимодействие основания и кислоты (реакция нейтрализации):
3NaOH + H3PO4 = Na3PO4 + 3H2O.
2. Взаимодействие основания с кислотным оксидом:
Ca(OH)2 + CO2 = CaCO3↓+ H2O.
3. Взаимодействие кислот с основным оксидом:
H2SO4 + CuO = CuSO4+ H2O.
4. Взаимодействие кислот или щелочей с амфотерным оксидом:
NaOH + ZnO = NaZnO2 + H2O.
5. Взаимодействие основного и кислотного оксида:
CaO + CO2 = CaCO3.
6. «Прямой» синтез из простых веществ
2Na + Cl2= 2NaCl.
7. Взаимодействие кислот с металлами:
Zn +2HCl = ZnCl2 + H2↑.
Задание на дом
Выучите материал этого раздела и приведенные в нем определения и примеры.
Тема 16. Валентность. Степень окисления. Окислительно-восстановительные реакции.
Термином «валентность» обозначают способность атома данного химического элемента образовывать с другими атомами определенное число химических связей. Понятие «валентность» возникло в первой половине ХIХ века, когда ученые считали, что атомы каждого элемента в химических соединениях всегда образуют строго определенное число связей с другими атомами.
У атомов углерода С, водорода Н, кислорода О и некоторых других элементов, входящих в состав органических соединений, это действительно так – атом С в органических соединениях практически всегда образует 4 связи (т.е. он всегда четырехвалентен), атом водорода Н – одну связь (он одновалентен), атом кислорода О – две связи (он двухвалентен). Однако атомы большинства элементов в неорганических соединениях могут образовывать различное число химических связей с другими атомами, причем число связей данного атома в большой степени зависит не от его природы, а от того, с атомами каких именно других элементов он связан.
При этом число связей атома данного элемента с другими атомами переменно и может изменяться от 1 до 6 – 8, а то и до 12 и даже до больших значений. Так, атом элемента хрома Cr в соединениях может образовывать от 1 до 10 и более связей (в зависимости от того, с чем и при каких условиях реагирует хром). К тому же однозначно экспериментально определить число связей данного атома с другими атомами во многих соединениях, особенно с ионными связями, довольно сложно. Так, в любом твердом ионном соединении каждый положительно заряженный ион притягивается ко всем отрицательно заряженным ионам, а каждый отрицательно заряженный ион — ко всем положительно заряженным ионам. Существуют и многочисленные соединения, в которых атомы металла связаны не только с атомами неметалла, но и между собой (например, в иодиде железа наряду со связями Fe – I есть связь Fe – Fe). Известны и другие группы соединений, где однозначно указать число связей данного атома с другими атомами или сложно, или вовсе невозможно. Даже для углерода имеются важные исключения из правила: во всех органических и твердых неорганических соединениях углерод «четырехвалентен». Так, в карбиде бора атом С связан с 6-ю атомами В, так что атом С в данном случае можно рассматривать как шестивалентный. Понятие «валентность» оказалось внутренне противоречивым и неоднозначным.
По этим причинамв середине ХХ века химики многих стран решили отказаться от использования понятия «валентность» в общей и неорганической химии. Опираясь на развитые в 30-е годы видным американским ученым В.М.Латимером представления об окислительных состояниях атомов элементов, американский химик-педагог и исследователь Дж.Кемпбел в 50-е годы предложил вместо термина «валентность» использовать термин «степень окисления» (в английском оригинале — «oxidation number», т.е. окислительное число). Степень окисления — это численная характеристика способности атомов химических элементов отдавать и принимать электроны. * Кемпбел предложил и правила нахождения степеней окисления атомов в соединениях.
Степень окисления может принимать как положительные, и отрицательные значения, быть целочисленной или дробной, равной 0. Обычно степень окисления указывают сверху над соответствующим атомом в формуле соединения:
 ,
, 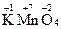 ,
,  ,
, 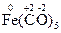 ,
, 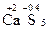
Для указания степени окисления используют и арабские, и римские цифры, которые в названии соответствующего соединения записывают в скобках за названием соответствующего элемента. Знак степени окисления приводят перед числом, отвечающим степени окисления. Так, для диоксида свинца PbO2 можно использовать названия: «оксид свинца(+4)» и «оксид свинца(IV)».
Так как степень окисления — величина условная, для ее определения сформулирован перечень специальных правил. Правила выглядят следующим образом:
1. Сумма степеней окисления в любой микрочастице (молекуле, ионе) равна электрическому заряду этой частицы. Если молекула образована атомами одного элемента, то степень окисления каждого атома этого элемента равна 0.
2. Любое правило определения степеней окисления имеет свой порядковый номер. При нахождении степеней окисления, когда действуют сразу два или большее число правил, прежде всего используют тому, которое имеет наименьший порядковый номер. Далее руководствуются следующим по порядковому номеру правилом и т.д.
3. Степень окисления атомов фтора F во всех соединениях этого элемента равна –1.
4. Атомы элементов группы №1 (группы IА) — атомы щелочных элементов – в соединениях всегда имеют степень окисления +1. Атомы элементов группы №2 (группы IIА) (магний, кальций и др.) в соединениях всегда имеют степень окисления +2. Степень окисления атомов алюминия в соединениях +3.
5. Степень окисления атомов водорода в его соединениях (кроме соединений с элементами групп №1 и 2, а также с Al), равна +1.
6. Степень окисления атомов кислорода в его соединениях равна -2, за исключением соединений, для которых справедливы правила 3 – 5.
7. Максимальная положительная степень окисления атомов элемента равна номеру его группы в короткой форме Периодической системы элементов Д.И.Менделеева. Максимальная отрицательная степень окисления атомов равна максимальной положительной степени окисления минус 8.
8. Если в состав сложного соединения или сложного иона входят более простые молекулы или ионы, то принимают, что в таких случаях присоединенные молекулы или ионы не меняют своей степени окисления. Например, принимают, что степень окисления, отвечающая молекуле СО, входящей в состав карбонилов [Fe(CO)5, Mn2(CO)10 и др.], равна 0. Если в состав комплексного иона входит молекула NH3, то степень окисления, отвечающая этой молекуле, равна также 0. В случае же иона аммония NH4+ степень окисления, отвечающую этому иону, принимают равной +1.
9. Если соединение образовано атомами с близкой электроотрицательностью, то при определении степеней окисления атомов в образуемых ими соединениях сначала более электроотрицательному атому приписывают максимальное значение его отрицательной степени окисления. Например, в случае соединения бромида иода IBr принимают сначала, что степень окисления более электроотрицательного атома — атома Br — равна –1, так как 7 – 8 = –1. Далее находят степень окисления иода, которая оказывается равна +1.
Экспериментально методом электронографии установлено, что в соединении SO2 электронная плотность у атома серы повышена по сравнению с электронной плотностью в свободном атоме серы. Тем не менее, руководствуясь правилами определения степеней окисления, находим, что в SO2 степень окисления более электроотрицательных атомов кислорода равна –2. Далее легко определить (правило №1), что степень окисления атома серы в этом соединении равна +4.
Рассмотрим несколько примеров применения указанных правил. Определим, например, степени окисления атомов в соединении Na2Cr3O10 (трихромат натрия). Степень окисления атомов Na равна +1 (правило №3), а степень окисления атомов О – –2 (правило №6). Обозначим степень окисления атома Cr через х и составим уравнение (правило №1):
+1•2 + 3 х + (–2)•10 = 0
Решая это уравнение, находим, что х = +6. Таким образом, степень окисления атомов хрома в Na2Cr3O10 +6.
Еще пример. Найдем степени окисления атомов в соединении KO2 (надпероксид калия). Степень окисления атомов калия равна +1 (правило №3). Обозначим степень окисления атомов кислорода через х и составим уравнение:
+1 + 2 х = 0
Решая уравнение, находим, что х = –0,5. Степень окисления атомов кислорода в данном случае – 0,5.
Понятие «степень окисления» используют при выявлении среди различных химических реакций тех, которые принадлежат к числу реакций окисления-восстановления, при отыскании коэффициентов в процессе уравнивания правой и левой частей уравнений таких реакций, при составлении названий соединений и в некоторых других случаях.
Химические реакции, при протекании которых степени окисления атомов изменяются, называют окислительно-восстановительными. Те атомы, степени окисления которых при этих реакциях повышаются, в ходе реакций окисляются, а те атомы, степени окисления которых понижаются – восстанавливаются.
Исторически представление об окислении и восстановлении возникло при изучении реакций металлов с кислородом (при этом металл как бы исчезает, превращаясь в «землю» – оксид) и восстановлении металла из оксида под действием соответствующих реагентов. В настоящее время окислением называют процесс, при котором происходит повышение степени окисления какого-либо атома. Так, при реакции
2СО + О2 = 2СО2
степень окисления атома С повышается от +2 в СО до +4 в СО2, поэтому говорят, что атом С в этой реакции окислился. Аналогично в реакции
2FeCl2 + Cl2 =2FeCl3
степень окисления атома Fe возрастает от +2 до +3, и поэтому в данном случае речь также идет об окислении железа.
Принято условно считать, что при окислении атом теряет электроны. В любом случае, когда в химической реакции какой-либо атом окислился, атом другого элемента (или другой атом того же самого элемента) обязательно должен восстановиться, т.е. понизить свою степень окисления. Восстановлением называют процесс, при котором происходит понижение степени окисления атома в ходе окислительно-восстановительной реакции. Так, если в реакции:
CuO + Н2 t =Cu + H2O
происходит понижение степени окисления атома меди от +2 в оксиде меди CuO до 0 в простом веществе меди, то говорят, что атом меди при этом восстановился.
Условно принимают, что восстановлению всегда отвечает присоединение электронов к атому (первоначально заряженному или нейтральному). Так, приведенный выше процесс восстановления меди в соответствии с этими представлениями сопровождается присоединением к каждому атому меди, имевшему в оксиде заряд +2, двух электронов, что можно передать записью:
Cu2+ + 2 е = Cu0.
В любой реакции, где произошло восстановление каких-либо атомов, обязательно происходит окисление других атомов. Можно сказать, что без окисления одних атомов не может быть восстановления других атомов, точно так же, как без восстановления одних атомов не может быть окисления других. Так, в приведенной выше реакции FeCl2 с хлором восстановились атомы хлора. Их степень окисления понизилась от 0 (в С12) до –1 в трихлориде железа FeCl3. Как и в случае восстановления, когда не бывает восстановления без окисления, так и не может быть окисления без восстановления.
Вещество, степень окисления атомов которого в результате протекания реакции понижается, называют окислителем. Так, в реакции:
2KMnO4 + 16HCl = 2KCl + 2MnCl2 +5Cl2↑ + 8H2O
атомы марганца в KMnO4 понижают свою степень окисления от +7 до +2 (в MnCl2) и поэтому перманганат калия KMnO4 выступает как окислитель.
При этом сами эти атомы марганца восстанавливаются и происходит окисление хлорид-ионов (степень окисления хлора –1) до свободного хлора (степень окисления атомов равна 0).
К числу наиболее типичных окислителей относятся: перманганат калия KMnO4, дихромат калия K2Cr2O7,пероксид водорода Н2О2, озон О3, гипохлорит натрия NaClO, хлорная известь CaCl(ClO) и другие соединения.
Вещество, степень окисления атомов которого в результате протекания реакции повышается, называют восстановителем. Например, в реакции
4НС1 + MnO2 = Cl2+ MnCl2 +H2O
восстановителем выступает соляная кислота (точнее говоря, существующие в растворе соляной кислоты ионы С1-, в которых атомы хлора имеют степень окисления –1). Наиболее типичные восстановители – это газы водород Н2, оксид углерода(II) (угарный газ) СО, метан СН4, аммиак NH3 и др.; щелочные металлы натрий Na, калий K и др., щелочноземельные металлы кальций Ca, стронций Sr, барий Ba; активные металлы магний Mg, алюминий Al; гидриды щелочных и щелочноземельных металлов (NaH, CaH2 и др.); тетрагидроалюминат лития LiAlH4 и др.
Задание на дом
Определите степени окисления атомов в следующих соединениях: С3О2, Fe(CO)5, H3AsO4, C12H22O11, KClO4, C2H6, K2Cr3O10, Na2O2, K2S5, AlF.
Тема 17. Нахождение коэффициентов в окислительно-восстановительных реакциях
В рамках школьной программы и ЕГЭ большое внимание уделяется нахождению коэффициентов, которые позволяют от схемы окислительно-восстановительного процесса перейти к уравнению соответствующей реакции. С этой целью можно использовать различные приемы. Подчеркнем, что все способы нахождения коэффициентов в окислительно-восстановительных реакциях не имеют никакого отношения к выявлению механизма реакций, т.е. тех реальных элементарных стадий, через которые протекает реакция, хотя авторы некоторых книг считают, что на основании формальной схемы переноса электронов можно вскрыть «механизм реакций», показать ее «сущность».
Наиболее часто в учебных процессах используют два метода нахождения коэффициентов в окислительно-восстановительных реакциях: метод электронного баланса (его применяют для реакций окисления-восстановления, протекающих с участием твердых и газообразных веществ) и метод электронно-ионного баланса, используемый для реакций, протекающих в растворах. Рассмотрим примеры нахождения коэффициентов этими методами.
1. Метод электронного баланса. Его обычно рассматривают на примере следующей реакции, отвечающей обжигу пирита FeS2 на воздухе:
FeS2 + O2 → Fe2O3 + SO2↑,
хотя этот процесс для получения SO2 в промышленности давно уже не используют. В ходе этой реакции происходит окисление атомов железа (их степень окисления повышается от +2 в исходном пирите до +3 в оксиде Fe2O3), окисление атомов серы (их степень окисления изменяется от –1 в пирите до +4 в SO2) и восстановление атомов кислорода (их степень окисления понижается от 0 в молекулярном кислороде до –2 в образующихся соединениях).
Для окисления атомов Fe+2 записываем полуреакцию:
Fe+2 – e = Fe+3.
В пирите на каждый атом железа приходится два атома серы, поэтому окислению этих атомов отвечает запись:
2S–– 10 e = 2S+4 .
Суммарно для обоих процессов окисления можно записать:
Fe+2 + 2S–– 11 e = Fe+3 + 2S+4.
Для полуреакции, отвечающей восстановлению кислорода, записываем:
О2 + 4 е = 2О-2.
Получаем систему двух полуреакций
4 Fe+2 + 2S––11 e = Fe+3 + 2S+4
11 O2 + 4 e = 2O-2
Уравняем число отданных в первой полуреакции и принятых во второй полуреакции электронов, т.е. добьемся их баланса. Для этого первую полуреакцию умножим на 4, а вторую – на 11. Далее суммируем по отдельности левые и правые части обеих полуреакций и находим:
4Fe+2 + 8S– + 11O2 = 4Fe+3+ 8S+4+ 22O-2.
Теперь можно расставить коэффициенты и получить уравнение окислительно-восстановительной реакции, отвечающей обжигу пирита:
4FeS2 + 11O2 = 2Fe2O3 + 8SO2.
2. Методэлектронно-ионного баланса. В этом методедля отыскания коэффициентов в уравнении реакции в записях полуреакций указывают не отдельные атомы, а ионы или молекулы, участвующие в процессе. При этом формулы нерастворимых в воде (CuS, As2S5 и т.д.) или мало диссоциирующих на ионы (H2S, H2O и т.д.) соединений записывают в молекулярной форме.
Рассмотрим в качестве примера использования метода электронно-ионного баланса нахождение коэффициентов в окислительно-восстановительной реакции, протекающей при действии на соляную кислоту НС1 сильного окислителя – дихромата калия K2Cr2O7.
Схема протекающей реакции следующая:
K2Cr2O7 + HCl → CrCl3 + KCl + Cl2↑ + H2O.
Окислителями в данной реакции служат ионы Cr2O72-. Атомы хрома в них находятся в степени окисления +6. В результате реакции возникают ионы Cr3+. Этому процессу отвечает запись:
Cr2O72- → 2Cr3+.
Для того, чтобы связать 7 атомов кислорода в молекулы воды, допишем в левую часть полуреакции 14 ионов Н+(реакция протекает в сильнокислой среде):
Cr2O72- + 14H+→ 2Cr3+ + 7H2O.
Теперь необходимо уравнять в правой и левой частях записи заряды. Для этого добавим в левую часть 6 отрицательных зарядов (электронов, е):
Cr2O72- + 14H++ 6 e = 2Cr3+ + 7H2O
Аналогично для процесса окисления хлорид-ионов можно записать:
2С1–– 2 е = Cl2
Для того, чтобы уравнять число отданных и принятых электронов (составить баланс электронов), умножим полуреакцию, отвечающую окислению хлорид-ионов, на 3, а затем просуммируем по отдельности правые и левые части обеих полуреакций:
|
|
|
|
|
Дата добавления: 2015-01-03; Просмотров: 451; Нарушение авторских прав?; Мы поможем в написании вашей работы!