
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Задачи на дом 7 страница
|
|
|
|
Cr2O72- + 14H++ 6Cl– = 2Cr3++ 7H2O + 3Cl2↑.
На основании этой записи расставляем коэффициенты в уравнении окислительно-восстановительной реакции:
K2Cr2O7 + 14HCl = 2KCl + 2CrCl3 + 3Cl2↑ +7H2O.
Аналогичным образом могут быть найдены коэффициенты окислительно-восстановительной реакции, протекающей в нейтральной или щелочной среде, но в щелочной среде следует оперировать ионами ОН–и молекулами воды.
Пусть, например, речь идет о реакции окисления бромом гидроксида хрома(III) в щелочной среде (в среде КОН). Условно примем, что гидроксид хрома(III) существует в щелочной среде в форме тетрагидроксокомплекса состава K[Cr(OH)4]. Схема протекающей реакции следующая
K[Cr(OH)4] + Br2 + KOH → K2CrO4 + KBr.
Для того, чтобы уравнять данную реакцию и найти соответствующие коэффициенты перед формулами веществ, составим схемы полуреакций, отвечающих окислению и восстановлению.
Окислению в данной реакции подвергаются атомы хрома Cr; их степень окисления повышается с +3 в K[Cr(OH)4] до +6 в K2CrO4. С учетом того, что в щелочной среде достаточно велика концентрация ионов ОН–, можно записать:
Cr(OH)4–+ 4OH– – 3 e = CrO42–- + 4H2O.
Почему перед анионом ОН – в левой части стоит коэффициент 4? Для перехода от аниона Cr(OH)4–к аниону CrO42-надо «связать» в молекулы воды 4 атома Н (точнее говоря, 4 заряженных атома Н+) из групп ОН. Так как для связывания одного атома Н+ в молекулу воды Н2О необходима одна группа ОН– (H+ + OH– = H2O), то очевидно, что для связывания в молекулы воды четырех атомов Н+ необходимы 4 группы ОН–.
Для процесса восстановления атомов брома Br (степень окисления которых понижается от 0 в Br2 до –1 в KBr):
Br2+ 2 e = 2Br–.
Записываем обе полуреакции одна под другой:
2 Cr(OH)4–+ 4OH-– 3 e = CrO42– + 4H2O
3 Br2 + 2 e = 2Br–
Для обеспечения баланса электронов (равенства числа принятых и отданных) первую полуреакцию умножим на 2, а вторую — на 3. Далее суммируем порознь правые и левые части полуреакций и получаем:
2Cr(OH)4–+ 8OH–+3Br2 = 2CrO42– +8H2O + 6Br–.
На этом основании записываем коэффициенты в уравнении протекающей реакции:
2K[Cr(OH)4] + 3Br2 +8KOH = 2K2CrO4 +6KBr +8H2O.
Рассмотрим также две реакции с участием пероксида водорода Н2О2. В следующей реакции пероксид водорода выступает как окислитель:
КI + Н2О2 → I2 + KOH.
Составляем полуреакции, первая из которых отвечает восстановлению молекул Н2О2 до ионов ОН–, а вторая – окислению иона I– до простого вещества иода I2:
2I– – 2 е = I2
Н2О2 + 2 е = 2ОН–.
На этом основании получаем уравнение:
2KI + Н2О2 = I2 + 2KOH.
В реакции с сильным окислителем — перманганатом калия KMnO4, протекающей в среде серной кислоты, пероксид водорода H2O2 выступает как восстановитель:
Н2О2 + KMnO4 + H2SO4 → O2↑+ MnSO4 + K2SO4+ H2O.
Этой реакции соответствуют следующие полуреакции, первая из которых отвечает процессу восстановления, а вторая — окисления:
2 MnO4– + 8H+ + 5 e = Mn2+ + 4H2O
5 Н2О2 – 2 е = О2 + 2Н+
Умножив первую полуреакцию на 2, а вторую — на 5, добиваемся баланса (равенства) чисел присоединенных и отданных электронов. После умножения суммируем эти полуреакции и находим, что:
5Н2О2 +2MnO4- + 6H+ = 5O2↑ + 2Mn2+ + 8H2O.
Эта запись дает возможность приведенную выше схему реакции превратить в уравнение реакции:
5Н2О2 + 2KMnO4 + 3H2SO4 = 5O2↑+ 2MnSO4 + K2SO4+ 8H2O.
Задание на дом
1. В приведенных ниже реакциях определите окислитель и восстановитель. Найдите коэффициенты, позволяющие от приведенных схем реакций перейти к уравнениям реакций.
а) Н2S + H2SO4 → S + H2O;
б) K2Cr2O7 + HCl → Cl2 + CrCl3 + KCl + H2O;
в) NH3 + O2 → NO + H2O;
г) Cu + HNO3 → Cu(NO3)2 + NO + H2O;
д) Cu + HNO3 → Cu(NO3)2 + NO2 + H2O;
е) Zn + HNO3 → Zn(NO3)2 + N2O + H2O;
ж) HCl + KMnO4 → Cl2 + KCl + MnCl2 + H2O;
з) Cl2 + NaOH → NaClO3 + NaCl + H2O;
и) As2S5 + HNO3 → H3AsO4 + H2SO4 + NO2 + H2O;
к) Sb2S3 + HNO3 → H3SbO4 + H2SO4 + NO2 + H2O.
2. Найдите коэффициенты, позволяющие от приведенных схем реакций перейти к уравнениям реакций.
а) Na2SO3 → Na2S + Na2SO4;
б) NO2 → HNO3 + NO + H2O,
в) H3 + O2 → P2O5 + H2O.
Тема 18. Гальванические элементы. Стандартные электродные потенциалы
Протекание окислительно-восстановительных реакций связано с переносом электрических зарядов. Если пространственно разделить области, где происходят процессы окисления и восстановления, то можно создать устройство, которое будет служить источником постоянного электрического тока. Такие устройства впервые были созданы на рубеже XVIII и XIX веков, когда не существовало представлений об электронах, их переносе и особенностях строения атомов разных элементов, подробно разработанных к настоящему времени. С помощью таких устройств в первом десятилетии XIX века англичанин Г. Дэви первым получил в свободном виде активные металлы натрий, калий, барий и другие, а русский физик В.В.Петров наблюдал непрерывный разряд в газе – электрическую дугу.
Устройства для получения электрического тока за счет окислительно-восстановительных реакций получили название гальванических элементов в честь итальянского ученого Л.Гальвани, который первым наблюдал, что при контакте разных металлов возможно возникновение электрического тока. Большой вклад в создание таких устройств внёс ученик Гальвани – А.Вольта, который разработал удобные приборы, в которых окислительно-восстановительные процессы приводят к появлению электрического тока.
Каждый гальванический элемент представляет собой ёмкость – ячейку, содержащую электролит (раствор или ионопроводящую пасту) и электроды, на поверхности которых протекают процессы окисления и восстановления. Электроды изготавливают из электропроводящего материала (обычно из металла или графита). Часто электрод представляет собой металлическую пластину или графитовый стержень. На поверхности одного электрода (его называют катодом) происходит процесс электрохимического восстановления, на поверхности второго электрода (его называют анодом) – процесс электрохимического окисления.
Если сам материал анода в электрохимическом процессе не участвует, то анод называют инертным. Такие аноды изготавливают, например, из графита или платины. Материал анода может непосредственно участвовать в электрохимическом процессе, тогда его называют активным.
В гальваническом элементе электрод, на котором происходит восстановление – катод, заряжен положительно, а электрод, на поверхности которого происходит окисление – анод, заряжен отрицательно.
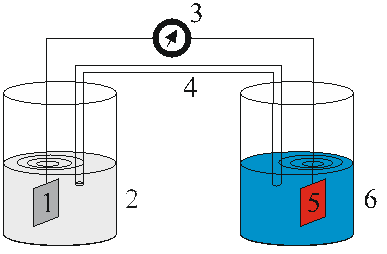
Рис.18. Схема цинк-медного гальванического элемента
1 – цинковый электрод, 2 – 0,1 моль/л раствор ZnSO4; 3 – гальванометр; 4 – солевой мостик; 5 – медный электрод; 6 – 0,1 моль/л раствор CuSO4.
На рис. 18 показана схема одного из возможных гальванических элементов. В данном случае анодом служит цинковая пластинка, опущенная в раствор соли цинка, например, в 1 моль/л раствор ZnSO4, а катодом – медная пластинка, опущенная в раствор соли меди, например, в 1 моль/л раствор CuSO4. Металлические пластинки через гальванометр соединены между собой металлической проволокой. Для обеспечения контакта растворов (для замыкания электрической цепи) использован стеклянный П-образный солевой мостик, наполненный раствором сильного электролита (например, 1 моль/л раствором К2SО4). Гальванометр показывает наличие тока в цепи (если только электроды соединены между собой, солевой мостик обеспечивает контакт соответствующих растворов и по нему могут перемещаться гидратированные ионы).
В гальваническом элементе, схема которого приведена на рис. 18, на аноде происходит процесс:
Zn – 2e-= Zn2+,
а на катоде – процесс:
Cu2+ +2e-= Cu.
Ток в замкнутой цепи, обеспечиваемый переходом электронов с цинковой пластинки на медную, наблюдается, пока полностью не растворится цинковая пластина или пока не израсходуются все ионы Cu2+ из окружающего медную пластинку раствора CuSO4.
Анализ поведения металлов в водных растворах показывает, что при их внесении в раствор, например в виде пластинки, между пластинкой и раствором возникает разность потенциалов (или, если использовать не совсем точную терминологию, напряжение). Возникновение разности потенциалов связано или с тем, что с поверхности электрода в раствор переходят положительно заряженные ионы металла, или с тем, что из окружающего электрод раствора на поверхность металла переходят ионы металла, находившиеся в растворе. Однако непосредственно измерить эту разность потенциалов не удается из-за очень малого расстояния между поверхностью электрода и ионами, перешедшими в раствор, а также по некоторым другим причинам. Поэтому определить абсолютное значение разности потенциалов для отдельных металлов не удается. Но для создания различных электрохимических устройств и для многих других целей нужно уметь характеризовать способность каждого металла переходить в раствор в виде ионов и обратный процесс перехода ионов металла из раствора на поверхность металла. Такую характеристику можно найти сравнительным методом. Ситуация здесь напоминает ту, которая была около двух веков назад, когда сами по себе массы атомов различных элементов не были известны, но можно было определить, во сколько раз масса атома, например, кислорода, больше массы атома водорода, принятого за единицу сравнения.
В качестве электрода сравнения выбран водородный электрод, свойства которого хорошо воспроизводимы в различных лабораториях мира. Водородный электрод представляет собой слой высокодисперсной платины (платиновой черни), нанесенный на пластинку из платины. Этот электрод опущен в 1 моль/л водный раствор высокочистой соляной кислоты, в котором молярная концентрация ионов Н+равна 1 моль/л (рис. 19). Температуру сосуда, в котором находится электрод и солянокислый раствор, поддерживают постоянной (обычно равной 25оС).
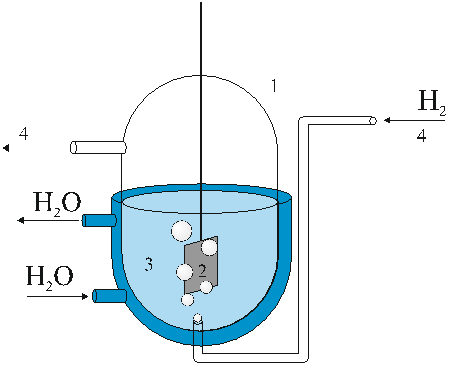
Рис. 19. Схема водородного электрода
1 - стеклянный сосуд с термостатированными стенками; 2- платиновый электрод, на поверхность которого нанесен тонкий слой платиновой черни; 3 – 0,1 моль/л раствор соляной кислоты; 4 – ток чистого газа водорода
Когда через сосуд вдоль поверхности электрода снизу вверх пропускают ток пузырьков чистого газообразного водорода Н2, он заметно растворяется в платиновой черни. На поверхности электрода протекает электрохимическая реакция с участием молекул водорода, находящихся в объеме платины, и ионов Н+ в растворе:
2Н+ + 2 е ̶ = Н2.
Стандартный потенциал, отвечающий этому процессу, принимают равным нулю, а все остальные электродные потенциалы измеряют относительно этого водородного электрода, составив электрическую цепь из испытуемого электрода, находящегося при 25оC в 1 моль/л растворе соответствующей соли, и находящегося также при стандартных условиях водородного электрода (рис. 20).
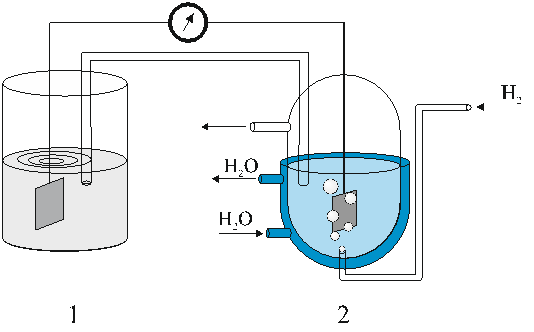
Рис. 20. Схема прибора для определения значений стандартного потенциала
1- сосуд с иccледуемым электродом; 2 – водородный электрод
При этом договорились, что потенциалам более активных, чем водород, металлов (магнию, алюминию, железу и др.) приписывают знак минус («—»), а потенциалам малоактивных металлов (меди, ртути, серебру, золоту и др.) — знак плюс («+»). Такая система знаков принята в «старом свете» (в странах Европы, в том числе и в нашей стране). В «новом свете» (США, Канаде и др.) используют противоположную систему знаков заряда стандартных электродных потенциалов.
Если все пары «металл в нулевой степени окисления — металл в степени окисления + n» расположить по возрастанию значений стандартного потенциала, то получится так называемый ряд стандартных потенциалов:
|
|
|
|
|
Дата добавления: 2015-01-03; Просмотров: 434; Нарушение авторских прав?; Мы поможем в написании вашей работы!