
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Опыт 2. Восстановительные и окислительные свойства пероксида водорода
|
|
|
|
Опыт 1. Получение кислорода
Экспериментальная часть
Теоретические вопросы
ЭЛЕМЕНТЫ VIA И VIIA ГРУПП
1. Электронное строение атомов элементов VIA и VIIA групп. Характерные степени окисления, примеры соединений в данных степенях окисления.
2. Валентности элементов VIA и VIIA групп. Особенности кислорода и фтора.
3. Изменение неметаллических свойств в группах и периодах на примере соединений VIA и VIIA групп.
4. Кислород. Озон. Пероксид водорода.
5. Сера. Сероводород. Сероводородная кислота. Оксиды серы. Сернистая кислота, сульфиты. Серная кислота, сульфаты.
6. Фтор. Фтороводородная кислота.
7. Хлор. Хлороводородная кислота. Оксиды хлора и кислородные кислоты хлора.
8. Бром, иод. Галогеноводородные кислоты, галогениды. Кислородные кислоты.
Поместите в сухую пробирку несколько кристалликов КМnO4. Укрепите пробирку в штативе вертикально и осторожно нагрейте в пламени горелки. Внесите в пробирку тлеющую лучинку и убедитесь в выделении кислорода. Напишите уравнение реакции разложения перманганата калия.
2KMnO4 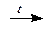 K2MnO4 + MnO2 + O2
K2MnO4 + MnO2 + O2
а) К 1 мл раствора перманганата калия KMnO4 в пробирке добавьте 1 мл раствора H2SO4 (2н) и 1 мл раствора H2O2 (3%). Обратите внимание на изменение цвета раствора. Напишите уравнение реакции, поставьте коэффициенты и укажите окислитель и восстановитель. Вычислите ЭДС реакции, молярные массы эквивалента окислителя и восстановителя.
б) Налейте в пробирку 1 мл раствора иодида калия, 1 мл раствора H2SO4 (2н) и 1 мл раствора Н2О2 (3%). Как изменился цвет раствора? Добавьте к раствору 1 мл крахмала. Какое вещество выделилось в ходе реакции? Напишите уравнение реакции, поставьте коэффициенты и укажите окислитель и восстановитель. Вычислите ЭДС реакции, молярные массы эквивалента окислителя и восстановителя.
|
|
|
|
|
Дата добавления: 2015-01-03; Просмотров: 562; Нарушение авторских прав?; Мы поможем в написании вашей работы!