
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Задачи и упражнения. Опыт 13. Сравнительная характеристика окислительных свойств галогенов
|
|
|
|
Опыт 13. Сравнительная характеристика окислительных свойств галогенов
Опыт 12. Экстракция хлора, брома и йода из водных растворов толуолом
Опыт 11. Окислительные свойства галогенов
В три пробирки налейте по 1-2 мл сероводородной воды и добавьте по каплям до появления мути в первую пробирку - хлорной воды (Cl2 aq), во вторую - бромной воды (Br2 aq), в третью - йодной воды (I2 aq). Напишите уравнения реакций взаимодействия сероводорода с галогенами.
Возьмите три пробирки и налейте в одну пробирку хлорной воды, в другую - бромной воды, а в третью - йодной воды. Прилейте в каждую пробирку по 1 мл толуола. Раствор перемешайте стеклянной палочкой и встряхните каждую пробирку несколько раз. Напишите наблюдения.
Возьмите три пробирки. В одну пробирку налейте 1-2 мл KBr, а в две другие пробирки налейте по 1-2 мл KI. Во все пробирки добавьте толуола (слой примерно в 1 см по высоте). Затем в пробирки с бромидом и иодидом калия прилейте по 1 мл хлорной воды, а в третью пробирку с иодидом калия - бромной воды. Содержимое пробирок перемешайте, осторожно встряхните и отметьте цвет слоя толуола. Напишите уравнения реакций, расположив галогены в ряд по уменьшению их окислительной активности.
1. Укажите возможные степени окисления следующих элементов: а) O; б) S; в) F; г) Cl; д) Br; е) I. Приведите примеры соответствующих соединений.
2. Какие свойства (основные, кислотные, окислительные, восстановительные) имеют соединения: а) O-1; б) S-2; в) S+4; г) S+6; д) Cl-1; е) Cl0. Напишите уравнения соответствующих реакций.
3. Напишите уравнения реакций:
KMnO4 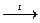
| KClO3 
|
FeS2 + O2 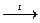
| KNO3 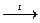
|
| NH3 + O2 ® | NH3 + O2 
|
| H2S + O2 ® | Ca + O2 ® |
| KI + H2SO4 + H2O2 ® | KMnO4 + H2SO4 + H2O2 ® |
4. Напишите уравнения реакций:
| ZnS + HCl ® | H2SO3 + H2S ® |
Zn + S 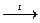
| H2SO3 + Br2 + H2O ® |
| Na2SO3 + HCl ® | SO2 + NaOH ® |
| KMnO4 + H2SO4 + H2S® | KMnO4 + H2SO3 ® |
| SO3 + H2SO4(конц.) ® | H2S2O7 + H2O ® |
| S + HNO3(конц.) ® | NaNO3(крист.) + H2SO4(конц.) ® |
| Ca + H2SO4(конц.) ® | Zn + H2SO4(конц.) ® |
|
|
|
5. Напишите уравнения реакций:
| Cl2O3 + KOH ® | H2O2 + KI ® |
| MnO2 + HCl(конц) ® | CuO + H2 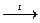
|
| Cl2 + NaOH ® | Fe + HCl ® |
| Cl2O5 + Ba(OH)2 ® | Cl2 + Ca(OH)2 ® |
| H2O2 + KNO2 ® | KMnO4 + HCl(конц.) ® |
KClO3 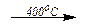
| Cl2 + KOH 
|
| Fe + Cl2 ® | NH3 + HCl ® |
6. Закончить уравнения реакций:
а) S ® SO2 ® H2SO3 ® NaHSO3 ® Na2SO3 ® Na2SO4 ® BaSO4
б) Zn ® ZnS ® H2S ® S ® SO2 ® SO3 ® H2SO4 ® BaSO4
в) FeS2 ® SO2 ® H2SO3 ® S ® Na2S ® NaHS ® H2S ® CuS
г) NaI ® NaBr ® NaCl ® Cl2 ® KClO3 ® KCl ® AgCl
д) Cl2 ® HCl ® Cl2 ® KClO ® KCl ® Cl2 ® Ca(ClO)2
е) Br2 ® HBr ® NaBr ® Br2 ® HBr ® KBr ® AgBr
7. При нагревании 245 г бертолетовой соли часть ее разложилась с выделением кислорода, а остальная часть соли - с образованием перхлората калия и хлорида калия. Определите массовую долю перхлората калия в твердом остатке, если выделилось 13,44 л кислорода (н.у.).
8. Газ, образовавшийся на аноде при электролизе раствора хлорида калия, полностью прореагировал с 750 мл 20% раствора иодида натрия с плотностью 1,20 г/мл с выделением иода. Определите массу образовавшегося при электролизе гидроксида калия.
9. При обжиге 100 г пирита получили газ, который очистили от примесей, а затем использовали для полной нейтрализации 400 мл раствора гидроксида натрия с массовой долей 0,25 и плотностью 1,28 г/мл. Определите массовую долю примесей в пирите.
10. При обжиге 72 г сульфида неизвестного двухвалентного металла выделился газ, который может обесцветить раствор, содержащий 80 г Br2. Определите этот металл.
11. Газ, полученный при обжиге пирита, растворили в воде. К раствору по каплям прилили бромную воду до прекращения обесцвечивания брома, а затем добавили избыток хлорида бария. Отфильтрованный и высушенный осадок имел массу 116,5 г. Определите массу пирита.
12. Через раствор, содержащий 4.5 г иодида натрия, пропустили 224 мл (н.у.) газообразного хлора. Раствор выпарили, а остаток прокалили при 300°С. Определите массу сухого остатка.
|
|
|
13. Хлорат калия подвергли термическому разложению в присутствии MnO2. Полученный остаток растворили в воде и добавили к нему избыток раствора нитрата серебра, получив осадок 43,05 г. Определите объем (н.у.) выделившегося при разложении хлората калия кислорода.
14. При частичном разложении пероксида водорода, находящегося в 100 г 3,4%-ного раствора, образовалось 0,56 л кислорода (н.у.). Какая часть пероксида водорода (в %) подверглась разложению?
15. Через 100 мл раствора иодида натрия с плотностью 1,20 г/мл пропустили газообразный хлор. При этом один из продуктов реакции при выпаривании раствора и прокаливании твердого остатка перешел в газообразное состояние. Масса прокаленного остатка составила 1,5 г. Определите массовую долю (%) иодида натрия, содержавшегося в исходном растворе.
Лабораторная работа 12
|
|
|
|
|
Дата добавления: 2015-01-03; Просмотров: 1375; Нарушение авторских прав?; Мы поможем в написании вашей работы!