
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Формулювання першого начала
|
|
|
|
Перше начало термодинаміки і форми запису
Формулювання нульового начала термодинаміки
ПЕРШЕ НАЧАЛО ТЕРМОДИНАМІКИ
Тепло Q не може безпосередньо перетворюватися в роботу L, а лише через інші форми енергії, наприклад U.
Загальні зауваги
1. Тепло і робота проявляються лише при протіканні процесів, тобто при змінах стану системи. Вони є лише формами передачи енергії, а не самою енергією. Тому не має смислу говорити про «запас тепла» чи «запас роботи». Вірним буде твердження, що тіло при даному процесі звершує певну роботу або отримало певну кількість тепла.
2. Робота і тепло є дві форми енергії, два потоки енергії від одного тіла до другого. Сам процес виконання або витрати роботи є процес переходу енергії від одного тіла до другого. При перебігу теплових процесів одне тіло віддає енергію у формі тепла, а друге дістає її.
3. Робота є організований потік енергії, зумовлений проявом направлених макрофізичних рухів, тепло є неорганізований потік енергії, зумовлений проявом хаотичних мікрофізичних рухів.
4. В термодинамічному процесі енергія може передаватися одночасно в формі Q і L.
5. Робота L безпосередньо перетворюється в інші форми енергії, в тому числі і Q.
3.2.1. Нульове начало термодинаміки (постулат)
Для ізольованої термодинамічної системи, яка знаходиться в рівноваговому стані, температура всіх її частин однакова. Якщо ізольована система знаходиться у нерівноваговому стані, температура її частин різна, але з часом енергія у формі тепла або у інших формах самочинно переходить від більш нагрітих частин системи до менш нагрітих, i цей процес продовжується до тих пір, поки не настане теплова рівновага, тобто поки не вирівняються температури всіх її частин.
Енергетична еквівалентність тепла і роботи доведена дослідним шляхом Юліусом Робертом Майєром (1842р.) і Джеймсом Джоулем (1843-1850рр.). Перше начало термодинаміки вперше сформульовано Саді Карно (1824р.), а потім в достатньо явній формі Германом Гельмгольцем (1847р.).
Перше начало термодинаміки є однією з окремих форм виразу фундаментального закону Природи збереження і перетворення енергії, який носить узагальнений характер, що прикладений до теплових явищ. Тому формулювання цього закону є, разом з тим, і формулюванням першого начала термодинаміки:
1. Енергія не створюється і не зникає, але має безмежну здатність перетворюватися з однієї форми в іншу в різних фізичних і хемічних процесах. Якщо певна кількість енергії зменшиться в одній системі, то на таку ж кількість її збільшиться в іншій системі.
2. Для ізольованої термодинамічної системи, яка знаходиться у рівновазі, повна її енергія є величина стала при будь-яких процесах, що відбуваються в системі:
Е = const. (3.32)
3. Для кінцевого процесу в ізольованій системі повна енергія початкового стану дорівнює повній енергії кінцевого стану:
Е1 = Е2 (3.33)
Е2 – Е1 = 0 (3.34)
4. Якщо система замкнена у непрониклу адіабатну оболонку і переходить із стану термодинамічної рівноваги, що визначається параметрами р1,v1,..., у новий стан рівноваги з параметрами р2, v2,..., то робота, що виконана при цьому, завжди є однаковою – вона не залежить від шляху переходу, а лише від початкового і кінцевого станів.
У замкнутій системі робота L виконується за рахунок зменшення внутрішньої енергії системи:
dL = - dU; (3.35)
Lg,1®2 = U1 - U2. (3.36)
5. Якщо система при термодинамічному процесі повернеться у початковий стан (початковий і кінцевий стани однакові), то робота циклу буде дорівнювати нулю:
 -
-  (3.37)
(3.37)
L0 = U1 - U1 = 0 (3.38)
6. Інакше кажучи, неможливо одержати відмінну від нуля роботу, не змінюючи стан робочого тіла, бо ніякими перетвореннями енергії неможливо збільшити її загальну кількість.
7. Якщо система не є ізольованою, то, внаслідок енергетичної взаємодії із зовнішнім середовищем, повна енергія кінцевого стану Е2 дорівнює повній енергії початкового стану Е1 плюс сума всіх енергій 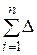 Еі, що система отримала внаслідок взаємодії із зовнішнім середовищем:
Еі, що система отримала внаслідок взаємодії із зовнішнім середовищем:
Е2 = Е1+ 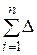 Еі , (3.39)
Еі , (3.39)
тобто, зміна повної енергії системи внаслідок взаємодії:
Е2 - Е1= 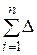 Еі. (3.40)
Еі. (3.40)
Сума енергетичних взаємодій складається з:
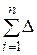 Еі = DЕк +DЕп +DU, (3.41)
Еі = DЕк +DЕп +DU, (3.41)
де DЕк − додаток енергії до системи від кінетичної енергії тіла в цілому;
DЕп – додаток до системи від потенціальної енергії положення тіла в цілому в силовому полі;
DU – зміна внутрішньої енергії системи.
Нехай DЕк = DЕп = 0, тоді приріст внутрішньої енергії відкритої системи і незамкнутого циклу, коли система не вертається у вихідний стан, можлива за рахунок двох форм енергії-роботи L і тепла Q. Тоді (3.41) запишемо так:
Е2-Е1= DU = DQ -DL. (3.42)
Для відкритої системи різниця між DQ і DL не дорівнює нулю і не залежить від шляху переходу між двома станами. Тоді перше начало сформулюємо так: приріст внутрішньої енергії системи, що взаємодіє із зовнішнім середовищем, дорівнює алгебраїчній сумі тепла і роботи.
8. У загальному випадку перехід системи з одного стану в інший пов’язаний з тим, що системі передається певна кількість тепла DQ і звершується системою робота DL над зовнішніми тілами.
У термодинамічному процесі кількість тепла дорівнює зміні внутрішньої енергії, доданій до зовнішньої (термодинамічної) роботи:
DQ = DL + DU, (3.43)
або в диференціяльній формі:
dQ = dU + dL (3.44)
Вираз (3.44) носить назву загальної форми запису першого начала термодинаміки. Для питомих величин (наприклад, масових)
dq= du + dℓ (3.45)
Для кінцевого оборотнього процесу 1®2
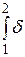 q =
q = 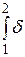 u +
u + 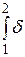 ℓ; (3.46)
ℓ; (3.46)
qx,1®2= (u2 - u1) + ℓx,1®2 (3.47)
де х – вид процесу.
Для циклу: 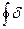 q =
q = 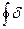 ℓ +
ℓ + 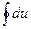 (3.48)
(3.48)
q0 = ℓ0, (3.49)
де q0, ℓ0 – тепло і робота циклу, а приріст внутрішньої енергії
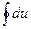 =0 (3.50)
=0 (3.50)
Для реальних (необоротніх) процесів:
q0 > ℓ0. (3.51)
Так як dL = pdV, (3.52)
dℓ = pdv, (3.53)
то запис (3.44) і (3.45) у формі
dQ = dU + pdV; (3.54)
dq = du + pdv. (3.55)
носить назву першої диференціяльної форми запису першого начала термодинаміки, яка має відповідну першу інтеґральну форму запису для даного кінцевого процесу:
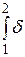 q=
q=  u +
u +  ; (3.56)
; (3.56)
qx,1®2 = (u2 - u1)+ 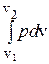 . (3.57)
. (3.57)
Введемо другу характеристичну функцію стану – ентальпію Н, h:
H =U + pV; (3.58)
h = u + pv. (3.59)
|
|
|
|
|
Дата добавления: 2014-12-25; Просмотров: 419; Нарушение авторских прав?; Мы поможем в написании вашей работы!