
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Поведение в окрестности стационарного состояния.
|
|
|
|
Если система в результате кратковременного воздействия (флуктуации некоторых обобщенных сил) выведена из стационарного состояния, т.е. σ получила положительное приращение ∆σ, то какова дальнейшая эволюция σ после флуктуации в виде двух компонент,
dσ =dXσ + dJσ, (2.92)
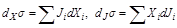 | |||
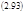 | |||
где
Поведение d σ определяется двумя теоремами.
Теорема 1. Если справедливы линейные феноменологические уравнения, соотношения взаимности Онзагера и Lij=const, (т.е. стационарное состояние и его окрестность недалеки от равновесия), то
dXσ = dJσ (2.94)
Доказательство:
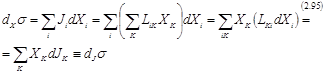 |
Теорема 2: Если фиксирование обобщенных сил неизменно во времени, то во всей области справедливости термодинамики необратимых процессов
dxσ ≤ 0 (2.96)
Доказательство этой теоремы в общем виде довольно громоздкое, и мы не будем его приводить; желающие могут ознакомиться с ним в книге [Пригожин].
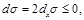 |  | ||
Объединяя обе теоремы, получим в итоге:
т.е. σ самопроизвольно возвращается к исходному минимальному значению.
Значит, если стационарное состояние недалеко от равновесия, то оно устойчиво по отношению к малым флуктуациям. Если стационарное состояние сильно не равновесно или флуктуации велики в этом же смысле, то вывод системы из первоначального состояния может оказаться необратимым. Доказанные теоремы, таким образом не закрывают путь самопроизвольному развитию неравновесной системы как переходу из одного состояния в другое. Рис. 2.6 иллюстрирует это.
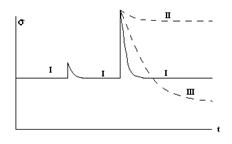
Рис. 2.6. Устойчивость состояния I к малым флуктуациям и возможные варианты «развития» системы (II, III) при больших возмущениях.
Теорема Пригожина и условия устойчивости стационарного состояния могут быть наглядно проиллюстрированы (рис. 2.7) для двух степеней свободы, при фиксированном значении Х1.
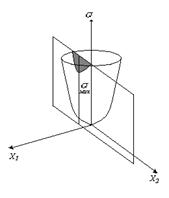
Рис. 2.7
Сечение параболоида плоскостью Х1=Х10 вырезает из него кривую σ(Х2), имеющую минимум в точке Х2=Х20. Это условный минимум, не равный нулю и соразмерный фиксированному значению Х10.
Если же Х10 «отпустить», то поиск минимума σ закончится опусканием в точку σ =0, при котором Х1 =0, Х2 =0 и стационарное состояние вырождается в состояние равновесия. В окрестности равновесия σ(Х1,Х2) представляет собой гладкий параболоид, однако при больших Х1 или Х2 на кривой могут появиться складки и карманы, создающие области со своими минимума σ, куда состояние системы может попасть при больших флуктуациях, как это показано на рис. 2.6.
Указанные теоремы можно рассматривать как обобщение принципа Ле-Шателье – Брауна. Этот принцип констатирует устойчивость равновесного состояния изолированной системы, утверждая, что процессы, вызываемые в системе внешними воздействиями, всегда направлены на уменьшение первоначального отклонения от состояния равновесия. Приведенные теоремы позволяют говорить о подобных свойствах неравновесной, но стационарной открытой системы. Многочисленные примеры такой устойчивости («гомеостаза») мы увидим при знакомстве с конкретными живыми системами и подсистемами. Однако многие из этих механизмов имеют общую термодинамическую природу, отражающую универсальные свойства открытой системы вблизи стационарного состояния. Эту мысль можно проиллюстрировать простыми примерами.
Рассмотрим простейшую открытую систему: плоскую полость с толщиной h с безграничной шириной. Пусть она помещена в безграничный раствор некоторого вещества, которое может проникать в полость через её боковые грани (рис.2.8.). Пусть проницаемость граней р1 и р2, а концентрация вещества слева и справа от полости низменны и равны а1 и а2, соответственно.
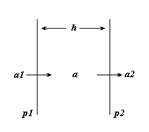
Рис. 2.8
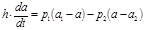 | 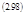 | ||
Тогда для концентрации вещества, а, внутри полости можно записать балансовое уравнение:
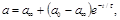 | 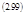 | ||
Считаем, что внутри полости вещество быстро перемешивается, так что его концентрация по толщине полости одинакова. Решение уравнения (2.98) имеет вид:

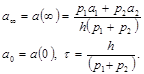 | 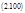 | ||
где
Это решение имеет характерные особенности:
1. Через t >> τ a(t) выходит на асимптотический (стационарный) уровень, который не зависит от начального значения а.
2. Попытки изменить стационарное значение, а∞, изменением а1 и а2 или р1 и р2 приведет лишь к ограниченному успеху. da∞/da1 и da∞/da2 меньше 1, а изменению а∞ при вариации р1 и р2 также невелики, т.к. р1 и р2 входят и в числитель, и в знаменатель а∞. Кинетика перехода от а0 к а∞ носит экспоненциальный характер.
Все эти три качества напоминают «гомеостаз» живой системы, хотя в конструкцию нашей простейшей модели не закладывались никакие специальные устройства, искусственно поддерживающие неизменность а∞. Это свойство автостабилизации стационарного состояния возникает автоматически в любой открытой системе, в которой обобщенные потоки линейно связаны с обобщенными силами. Любое изменение а тут же вызывает соответствующее изменение притока и вывода вещества через границы системы, стабилизируя значение а.
Второй пример позволяет учесть возможные химические превращения в объеме полости, моделируя «желудок и переваривание» (рис 2.9.)

Рис. 2.9
Пусть слева от полости находится вещество А, с неизменной концентрацией а1, а справа только В с неизменной концентрацией b1, а в полости они превращаются друг в друга по законам реакции первого порядка с константами скоростей К / и К //.
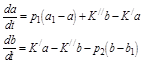 | 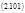 | ||
 Проницаемость левой грани к веществу А равна р1, а правой грани к В равна р2. Тогда кинетическое уравнение можно записать так:
Проницаемость левой грани к веществу А равна р1, а правой грани к В равна р2. Тогда кинетическое уравнение можно записать так:
Их решения имеют вид:
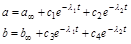
,
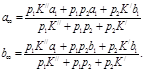 | 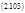 | ||
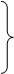 где
где
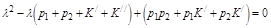 | 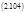 | ||
λ1, λ2 – корни характеристического уравнения:
Как легко видеть, λ1 и λ2 положительны. Здесь также, как и в предыдущем случае, через время t> λ1-1, λ2-1 система «забывает» о начальном положении и выходит на стационарное значение а∞ и b∞, обладающие устойчивостью по отношению к изменению всех своих параметров. Однако, помимо этого свойства, напоминающего гомеостаз в живом объекте, данная система демонстрирует нетривиальную кинетику переходного процесса. При изменении параметров стационарные значения переходят к новым значениям тремя способами: монотонным и двумя немонотонными (рис. 2.10.) в зависимости от начальных условий и значений λ1 и λ2. Переходы такого типа характерны для многих биологических систем. Например, сложный переход с «овершутом» (тип 2) напоминает изменение уровня сахара в крови млекопитающих, а нетривиальный «ложный старт» (тип 3) – вариацию напряжения кислорода в корешках лука при изменении парциального давления О2.
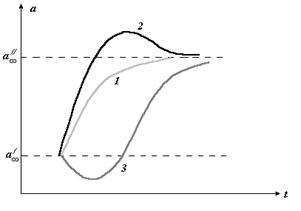
Рис. 2.10
Обычно предполагается, что такие сложные переходные процессы отражают работу специальных устройств контроля и регулирования. Но, как видим, это может быть простым свойством открытых неравновесных систем, в которых автостабилизация стационарного состояния происходит сама собой.
Вообще, следует сказать, что представление о необходимости существования сложных специальных устройств, регулирующих контроль и управление в живых клетках и тканях, вероятно, сильно преувеличено. Сложное «целесообразное» поведение живых объектов может быть обеспечено простыми механизмами, основанными на свойствах открытых систем и кинетики реакции, подчиняющихся закону действующих масс. А если скорости реакций определяются катализаторами (ферментами), то уже простейшие предположения о свойствах ферментов позволяют понять и описать всю сложность поведения биохимической системы.
Так, например, если вещество А способно участвовать в двух альтернативных превращениях по типу реакций первого порядка, давая два разных продукта В и С, то для их концентрации а, b, c, соответственно, можно записать:
 |
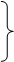
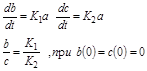 |
Наблюдая за ростом концентрации веществ В и С, мы будем фиксировать b >> с, если К1>>К2. При большой концентрации вещества В можно даже не заметить в этих условиях присутствие вещества С. Однако, если реакции ферментативны, и неравенство К1>>К2 обусловлено высокой активностью фермента Е1 при его концентрации значительно более низкой, чем концентрация фермента Е2, то с ростом концентрации исходного вещества, может произойти насыщение скорости первой реакции. Если при этом константа К2 остается неизменной, то нарастающая концентрация вещества С может значительно превысить концентрацию вещества В (рис 2.10). Создается ошибочное впечатление о наличии специального переключателя скоростей процессов при а=а*, которого на самом деле нет.
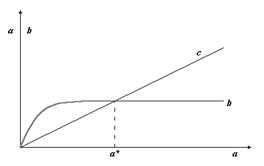 |
Рис. 2.10
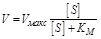 | 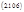 | ||
При этом мы не делали никаких дополнительных предположений о свойствах ферментов, кроме тривиальной зависимости скорости ферментативной реакции от концентрации субстрата (уравнение Михаэлиса-Ментен):
где [ S ] – концентрация субстрата, КМ – константа Михаэлиса, зависящая лишь от молекулярных параметров фермента и субстрата.
В более общем случае, когда КМ может зависеть от концентрации субстрата и (или) других веществ, поведение системы может стать неизмеримо сложнее и способно описать большой класс реально наблюдаемых свойств биохимических процессов. При этом в основе кинетики процессов попрежнему лежит закон действующих масс, но константы скоростей перестают оставаться постоянными. Факторами, влияющими на активность ферментов, иногда выступают молекулы АТФ, но чаще циклические АМФ, концентрация которых в свою очередь контролируется гормонами.
В совокупности эти проявления обратных связей и элементов регулирования констант скоростей создают сложную и динамичную структуру системы взаимопревращений веществ в биохимических системах. Её анализ представляет собой сложную задачу. Однако есть несколько подходов, позволяющих значительно упростить её. Прежде все6го это два известных принципа упрощения вида сложной сети. Первый – принцип Либиха (принцип «узкого места»): в последовательной цепи превращений наибольшее влияние на скорость образования конечного продукта оказывает реакция с наименьшей скоростью. Второй – принцип Хиншельвуда: в системе альтернативных процессов важнейшими являются те, которые идут с наибольшими скоростями и остаются реакциями первого порядка (т.е. не насыщаются) в наибольшем диапазоне концентраций субстратов. Использование этих простых принципов позволяет исключить из сети превращений менее существенные.
 |
 Важным для дальнейшего упрощения является редукция системы, основанная на анализе временной иерархии процессов. Часто систему кинетических уравнений для концентрации реагентов Х системы можно разбить на три группы:
Важным для дальнейшего упрощения является редукция системы, основанная на анализе временной иерархии процессов. Часто систему кинетических уравнений для концентрации реагентов Х системы можно разбить на три группы:
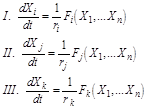 |
где характерные времена τi, τj, τk для концентрации Х в группах реагентов I, II, III, соответственно, удовлетворяют условию
τi<<τj<<τk (2.108)
На интервале времен t>>τI концентрации реагентов группы I успевают достигнуть своих стационарных концентраций и их динамику можно описать алгебраическим уравнением:
Fi (Xi,…Xn)= 0 (2.109)
вместо дифференциального:
На интервале t>>τIII концентрации реагентов группы III не успевают измениться и их можно считать постоянными, заданными в начальный момент:
Xk=Xk0=const (2.110)
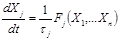 | 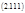 | ||
В итоге исходная система редуцируется и на интервале t≈τi приобретает существенно меньший порядок:
Управление такой редуцированной системой значительно упрощается: за переменными группы I не нужно следить, а переменные группы III приобретают смысл управляющих препаратов. Живая природа в процессе эволюции не могла пройти мимо этой возможности, ибо подобное упрощение системы увеличивает её надежность. Этот принцип простоты остроумно сформулировал философ екатерининских времен Г.С. Сковорода, сказавший примерно следующее: «Слава тебе, боже, за то, что ты сделал все нужное простым, а все сложное – ненужным!»
Этот принцип должен давать организмам большие преимущества в борьбе за существование. Те же, кто его не успел использовать в ходе эволюции, должны были вымереть. Если это так, то должна сложиться парадоксальная ситуация: математическое моделирование живой биохимической системы должно быть проще, чем искусственного биохимического реактора с тем же количеством степеней свободы, т.к. последний ещё не прошёл естественного отбора.
 |
 Наглядным примером продуктивности использования вышеуказанного принципа простоты (точнее, принципа стационарных состояний, основанного на известной теореме А.Н. Тихонова) является история исследования системы гликолиза в живой клетке. Моделируя сложный метаболизм глюкозы, Чанс и Гарфинкель в середине прошлого века написали 22 дифференциальных уравнения и провели анализ их численных решений, использовав имеющуюся в их распоряжении вычислительную машину. Этот анализ не выявил ничего интересного. В то же время Молчанов и Сельков, не имея такой технической возможности, провели более интеллектуальную атаку на эту систему и смогли редуцировать её к двум уравнениям:
Наглядным примером продуктивности использования вышеуказанного принципа простоты (точнее, принципа стационарных состояний, основанного на известной теореме А.Н. Тихонова) является история исследования системы гликолиза в живой клетке. Моделируя сложный метаболизм глюкозы, Чанс и Гарфинкель в середине прошлого века написали 22 дифференциальных уравнения и провели анализ их численных решений, использовав имеющуюся в их распоряжении вычислительную машину. Этот анализ не выявил ничего интересного. В то же время Молчанов и Сельков, не имея такой технической возможности, провели более интеллектуальную атаку на эту систему и смогли редуцировать её к двум уравнениям:
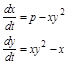 |
где х и у концентрации Фруктозы-6-фосфата и АДФ, соответственно. Исследование системы (2.112) позволило предсказать возможность автоколебаний в системе гликолиза, которые в последствии и были обнаружены экспериментально.
|
|
|
|
|
Дата добавления: 2014-12-26; Просмотров: 817; Нарушение авторских прав?; Мы поможем в написании вашей работы!