
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Остальное
|
|
|
|
О
||
Н3С─С─S─СоА
Рис. 3.5. Сокращённая структура ацетил-СоА.
Использование высокого восстановительного потенциала ацетил-СоА происходит в последующем процессе его ступенчатого окисления до СО2 и СоА в цикле трикарбоновых кислот (иначе, цикле лимонной кислоты), называемом также циклом Кребса. Освободившийся СоА вновь восстанавливается пируватом до ацетил-СоА и цикл повторяется. В результате окисления молекул ацетил-СоА восстанавливаются подвижные переносчики электронов НАД и ФАД, фосфорилируются молекулы гуаниндифосфата (ГДФ) – аналоги молекул АДФ - до ГТФ (аналогов АТФ) и выделяется СО2. Окисление ацетил-СоА - также бескислородный процесс, но он возможен только в аэробных условиях, так как восстановленные продукты этого цикла НАДН2 и ФАДН2 регенерируются и обеспечивают непрерывную работу цикла только в присутствии кислорода. Окисление этих переносчиков происходит на заключительном этапе третьей стадии с непосредственным участием молекулярного кислорода в качестве терминального акцептора электронов. Химическими продуктами этого этапа являются вода и молекулы АТФ, полученные посредством фосфорилирования АДФ, а также НАД и ФАД, после окисления НАДН2 и ФАДН2. НАД и ФАД возвращаются на предыдущие этапы процесса окисления глюкозы, обеспечивая непрерывность процесса в целом.
Третья стадия – образование ацетил-СоА из пирувата и жирных кислот, а также его дальнейшие превращения – протекает внутри клеточных органелл (митохондрий). Ферменты, ведущие реакции этой стадии, локализованы в тонкой сильно складчатой мембране, отделяющей внутренность митохондрии (матрикс) от цитоплазмы клетки и называемой сопрягающей. У бактерий, не имеющих митохондрий, сопрягающая мембрана охватывает весь объём клетки и располагается непосредственно под наружной оболочкой бактерии.
Итоговая стехиометрия цикла Кребса такова:
Ацетил-СоА + 3НАД + ФАД + ГДФ → СоА + 2СО2 + 3НАДН2 + ФАДН2 + ГТФ (3.9)
В свою очередь на заключительном этапе окислительного фосфорилирования в митохондриях на каждую молекулу окисляемого НАДН2 образуется3 молекулы АТФ, а на каждую молекулу ФАДН2 – 2 молекулы АТФ.
Теперь можно подсчитать полный энергетический баланс окислительного фосфорилирования в клетке. В процессе гидролиза одной молекулы глюкозы до двух молекул пирувата в цитозоле образуется 2 молекулы АТФ и 2 молекулы НАДН2. При превращении 2 молекул пирувата в 2 молекулы ацетил-СоА в митохондриях образуется ещё 2 молекулы НАДН2. Цикл Кребса также в митохондриях, окисляя 2 молекулы ацетил-СоА, производит 2 молекулы ГТФ, 2 молекулы ФАДН2 и 6 молекул НАДН2. Окисление всех 10 молекул НАДН2 на мембранах митохондрий даёт 30 молекул АТФ, ещё 4 молекулы добавляет мембранное окисление 2 молекул ФАДН2. Добавляя к этому 2 молекулы АТФ от цитозольной стадии гликолиза, и учитывая энергетическую эквивалентность ГТФ и АТФ, получим в итоге энергию эквивалентную 38 молекулам АТФ. Правда, мы включили в число окисляемых молекул 2 молекулы НАДН2, образовавшиеся вне митохондрий. Внешняя мембрана митохондрий непроницаема для НАДН2. Однако в клетках печени и сердца существует так называемый малатный механизм передачи восстановительного потенциала наружных молекул НАДН2 на внутренние без потери. И наш подсчёт справедлив. В некоторых других клетках (например, летательных мышцах насекомых) используется не столь совершенный механизм передачи потенциала (его называют глицерофосфатным челноком), при котором восстановительный потенциал цитозольного НАДН2 снижается до потенциала ФАДН2 в митохондриях. Это приводит к снижению общего энергетического выхода на 2 молекулы АТФ.
Теперь легко сделать оценку коэффициента преобразования энтальпии глюкозы в энтальпию АТФ:
η = 38x7,3/686 = 0,4 (3.10)
Это значительно больше, чем 2%, полученные на этапе гликолиза. Но при реальных условиях, когда активности участников отличаются от стандартных, при подсчёте эффективности преобразования свободной энергии к энтальпийному члену необходимо добавлять энтропийный (формула 2.58) и результат может быть ещё больше. Проделаем в качестве упражнения такой расчёт, используя типичные значения активностей для клеток печени: [Гл.] = 5 mM, [АТФ] = 3,5 mM, [АДФ] = 1,5 mM, [Ф] = 5 mM, [О2] = 0,1 атм, [СО2] = 0,06 атм. Уравнение полного окисления глюкозы: и синтеза АТФ:
Гл.(С6Н12О6) + 6О*2 + 6Н2О → 6СО2 + 12 Н2О* (3.11)
38 АДФ + 38Ф →38АТФ (3.12)
Значёк * напоминает, что кислород, поглощаемый при дыхании, входит в состав выделяемой воды, а не в СО2 , как иногда думают. Соответствующие изменения свободной энергии в ккал на моль глюкозы:
Агл = 686 + RT· ln {[Гл.]·[O2 ]6/[CO2]6} = 686 + 1,42·lg{5·10-3·(0,1/0,06)6} = 685 кк/М (3.13)
ААТФ = -7,3 + RT·ln {[АТФ]/[АДФ]·[Ф]} = -7,3 – 1,42·lg 3,5·10-3/1,5·10-3·5·10-3 = -11,4 кк/М (3.14)
Здесь мы учли, что натуральный логарифм в 2,3 раза больше, чем десятичный, а множитель RT перед логарифмом при температуре 310° К (т. е. 37° С) равен 0,62 кк/М. Теперь для коэффициента преобразования получим:
η = 38·11,4/685 = 0,63 или 63%! (3.15)
Это очень впечатляющая величина.
3.4. Окислительно-восстановительный потенциал.
В предыдущих разделах мы использовали представление об окислительно-восстановительных («редокс») процессах. Как и для всяких химических превращений направление и скорость редокс-реакции определяется её химическим сродством. Как уже упоминалось, общим признаком редокс-процессов является перенос электронов между реагентами, который приводит к окислению донора и восстановлению акцептора. По международной конвенции (Стокгольм, 1953 год) общее уравнение редокс-реакции записывается так:
Ox + Ze - = Red z-, (3.16)
т. е. за положительное направление процесса принято восстановление акцептора Ox с образованием окисленного донора Red z- в качестве продукта реакции. При этом отрицательный заряд продукта не следует воспринимать буквально: это обозначает лишь относительное увеличение его электронного заряда. По определению (2.58) сродство этой реакции:
A = A0 + RT·ln [Ox]/[Redz - ] (3.17)
Общий вид редокс-реакций (3.16) позволяет выразить сродство через удобную общую величину: окислительно-восстановительный (редокс) потенциал Е, приняв по определению:
E = A/ZF + Е0 = А0/ZF + RT / ZF·ln [Ox] / [Redz - ] = E0 + kT / Ze·ln [Ox] / [Redz - ] (3.18)
Здесь E0 –значение потенциала при стандартных условиях. Редокс-потенциал принято выражать в вольтах. В соответствии с определением (3.18) его величина тем более положительна,. чем более положительна величина А, т. е. чем больше стремление реакции (3.16) идти направо. Это создаёт удобное качественное правило: чем более положительным потенциалом обладает редокс-пара, тем она более привлекательна для электронов, как будто некий электрод притягивает переносимые электроны.
Рассмотрим это на важном примере. Редокс-потенциал пары протон – водород, связанной уравнением реакции:
2Н+ + 2е- = Н2 (3.19)
имеет редокс-потенциал:
EH+/H2 = E0 H+/H2 + (RT/2F)·ln [H+]2/[H2] (3.20)
Переходя к десятичным логарифмам и учитывая, что -lg [H+] это – рН среды, а активность газообразного водорода это – его парциальное давление в атмосферах, получим из (3.20) при температуре 37ºС:
EH+/H2 = E0 H+/H2 – 0,060·рН – 0,03·lgРН2 Вольт. (3.21)
При стандартных условиях, когда активность ионов водорода равна единице, а парциальное давление Н2 – одна атмосфера, это даёт: EH+/H2 = E0 H+/H2. Международная конвенция рекомендует все окислительно-восстановительные потенциалы отсчитывать от этого значения. Это создаёт водородную шкалу редокс-потенциалов, в которой стандартный потенциал пары ион водорода-водород при всех температурах равен нулю. Стандартные условия для этой пары реализуются на так называемом водородном электроде. Он представляет из себя чернёную платину, обдуваемую водородом при атмосферном давлении и помещённую в раствор кислоты с рН = 0. В таком устройстве устанавливается равновесное распределение электронов между Н+, Н2 и металлической Pt. Этот электрод используется как эталон для калибровки других, более практичных электродов, например, широко используемого в экспериментах однонормального хлор-серебрянного электрода (Cl - /AgCl, Ag; E0 = 0,222 В) или насыщенного каломельного (Cl-/Hg2Cl2, Hg; E0 = 0,241 В) При нейтральном значении рН потенциал водородного электрода свигается в соответствии с формулой (3.21) до значения –0,41 вольта при комнатной температуре.
Другая важная редокс-пара – это кислород-вода:
O2 + 4Н+ + 4e– = 2H2O (3.22)
Стандартный потенциал её равен +1,23 В. При нейтральной кислотности (рН=7) потенциал кислородной пары сдвигается до значения +0,82 В. В соответствии с приведенным правилом для редокс-потенциалов сродство электронов к кислороду больше, чем к водороду на 1,23 эВ при стандартных условиях. Это означает энергетическую выгодность перехода электронов от водорода к кислороду, в полном согласии с известной из химии электроотрицательности кислорода. Полезно отметить, что величины потенциалов водородной и кислородной пары изменяются при изменении рН, но алгебраическая разница между ними составляет 1,23 В и не зависит от рН. На этом интервале значений расположены стандартные редокс-потенциалы подавляющего большинства участников окислительно-восстановительных процессов в клетке. Примеры приведены в Таблице 2, в которой стандартные потенциалы пар указаны по водородной шкале, сдвинутой к нейтральному значению рН, характерному для живой клетки.
Таблица 2.
| Донор | Акцептор | Z | Редокс-потенциалы при рН 7, вольты |
| Zn | Zn++ | -0,76 | |
| Ацетальдегид | Альдегид | -0,60 | |
| Пируват + СоА | Ацетил-СоА | -0,48 | |
| Ферродоксин | Ферредоксин | -0,43 | |
| Н2 | 2Н+ | -0,42 | |
| НАДФ·Н2 | НАДФ | -0,42 | |
| НАД·Н2 | НАД | -0,32 | |
| ФМН·Н2 | ФМН | -0,30 | |
| ФАД·Н2 | ФАД | -0,23 | |
| Этанол | Ацетальдегид | -0,20 | |
| Лактат | Пируват | -0,19 | |
| Убихинон восстановленный | Убихинон окисленный | +0,04 | |
| Цитохром в2+ | Цитохром в3+ | +0,07 | |
| Аскорбат | Дегидроаскорбат | +0,075 | |
| СоQ | СoQ++ | +0,12 | |
| Н2S | S | +0,17 | |
| Цитохром а2+- | Цитохром а3+ | +0,28 | |
| Cu | Cu++ | +0,34 | |
| Цитохром а32+ | Цитохром а33+ | +0,55 | |
| Fe++ | Fe+++ | +0,77 | |
| Ag | Ag+ | +0,8 | |
| 2·Н2О | O2 | +0,81 | |
| Pt | Pt++ | +1,2 | |
| 2Cl- | Cl2 | +1,36 | |
| 2F- | F2 | +2,87 |
Спонтанный перенос электронов между двумя редокс парами в стандартных условиях может происходить только в направлении редокс-потенциалов сверху вниз по таблице. Обратный перенос требует дополнительного источника свободной энергии. При специально устроенном контакте двух пар термодинамический потенциал переноса может быть реализован в виде электродвижущей силы гальванического элемента. Например, пары Zn/Zn++ и Cu++/Cu образуют элемент Даниеля с э.д.с. 1,1 вольта. Пары, выходящие вверх за интервал между водородной и кислородной парами, являются сильными восстановителями. Пары внизу таблицы являются сильными окислителями и опасны для метаболизма клетки. Такие элементы как Ag+ и Pt++ проявляют бактерицидные свойства, а Cl2 и F2 известны как сильные яды.
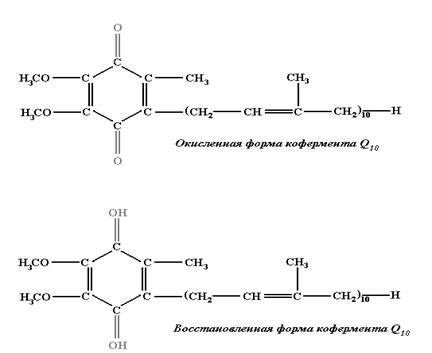 |
При окислительно-восстановительных превращениях сложных соединений изменения в их структуре могут затрагивать лишь малую их часть, играющую роль активного центра. Из рисунков 3.6 и 3.7 видно, что изменения касаются только состояния фенольного кольца в Q10 и части гетероциклов в ФМН и не затрагивают остальную часть этих больших молекул. В свою очередь изменения в остальной части молекул или другие факторы, изменяющие окружение активного центра, могут изменять значение стандартного редокс-потенциала. Это важное обстоятельство может использоваться клеткой для управления потоками электронов.
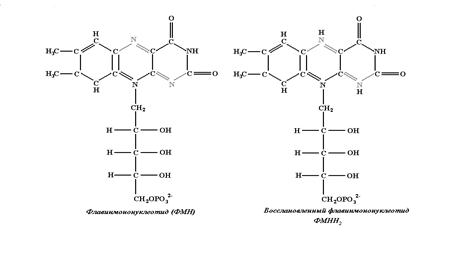 Рис. 3.6. Изменения в коферменте Q10 в ходе окислительно-восстановительной реакции.
Рис. 3.6. Изменения в коферменте Q10 в ходе окислительно-восстановительной реакции.
Рис. 3.7. Изменения в структуре флавинмононуклеотида при его восстановлении.
В живой клетке реальный перенос восстановительных эквивалентов может осуществляться различными способами:
· Посредством передачи электронов, иногда сразу по два (или по четыре), как в случаях с цитохромами или металлами переменной валентности.
· Переносом атомов водорода, иногда парами, как при превращениях хинонов (убихинон, CoQ) и рибофлавинов (ФАД и ФМН).
· Передачей гидрид иона (: Н –), как при превращениях НАДН2↔НАД, которые мы для краткости обозначаем как перенос 2 атомов водорода, а на самом деле эта реакция двухэлектронного восстановления выглядит так:
НАД+ + Н+ + Н – = НАДН + Н+ (3.23)
Ион водорода не входит непосредственно в восстановленную молекулу, а «болтается» в
растворе около неё.
· Прямым взаимодействием субстрата с кислородом и внутримолекулярным перемещением электрона как, например, при окислении углеводорода до спирта:
R–CH3 + (1/2)·O2 → RCH2–OH (3.24)
Для того, чтобы использовать окислительно-восстановительные потенциалы реагентов для анализа возможности протекания тех или иных редокс-процессов нужно знать не только стандартные потенциалы участников, но и их реальные значения. Как и химическое сродство любой химической реакции, реальный редокс-потенциал содержит помимо энтальпийного члена, Е0, ещё энтропийный (второй в выражении (3.18)), зависящий от активности участников процесса. Только их сумма определяет реальные значения редокс-потенциалов. А активности участников метаболизма часто значительно отличаются от стандартных значений, они непостоянны и зависят от состояния клетки в данный момент. В свою очередь соотношение активностей восстановленных и окисленных субстратов внутри каждой редокс пары зависит от того редокс-потенциала, который имеет данный элемент объёма клетки. Живая клетка – сильно неравновесная система и, вообще говоря, отдельные её части, тем более отдельные её компартменты, могут не успевать приходить в электрохимическое равновесие между собой.
Равновесное соотношение активностей восстановленной и окисленной форм метаболита при том значении редокс-потенциала, которое характеризует рассматриваемую часть клетки, можно найти из соотношения (3.18). Пусть доля активности окисленной формы вещества в общей активности aox/a = x, тогда доля восстановленной - ared / a = 1 – x. Подставим это в формулу (3.18):
E = E0 + (RT/zF)·lnx/(1 – x) → E –E0 = (kT/ze)·lnx/(1 – x) →x/(1 –x) = exp[(E –E0)ze/kT] →
x = exp[(E –E0)ze/kT]/{1 + exp{(E –E0)ze/kT]}
График этого решения показан на рис. 3.8.

Рис. 3.8. Зависимость доли окисленной формы реагента от редокс-потенциала среды.
Это - распределение Ферми. Е0 – энергия Ферми, и х(Е0) = 0,5, т. е. окисленные и восстановленные формы реагента находятся в равновесии. При Е→+¥ доля окисленной формы асимптотически приближается к 1. В живой клетке все участники окислительно- восстановительных реакций находятся в состоянии постоянного взаимного обмена восстановительными эквивалентами, в котором задействованы все указанные типы обмена. При этом в каждом месте устанавливается некий средний взвешенный редокс-потенциал среды, который и определяет преимущественное направление реакций. Если в клетку поступают извне восстановленные соединения (пищевые субстраты), то средний редокс-потенциал её поднимается (в сторону отрицательных значений), и поток восстановительных эквивалентов направляется преимущественно на восстановление тех участников, которые в текущем состоянии окислены, в том числе и относительно высоко лежащих, ведущих к запасанию энергии. При поступлении в клетку окислителя (кислорода) увеличивается доля глубоко окисленных состояний, средний редокс-потенциал клетки опускается и электронные потоки перераспределяются в сторону более полного окисления пищевых субстратов. Таким образом средний редокс-потенциал клетки оказывается важным управляющим параметром, изменяющим вклад различных энергетических механизмов в зависимости от текущей ситуации. При этом автоматически согласуются процессы запасания и использования энергии.
Обобщая вышесказанное, можно заключить, что, выбрав в качестве основного источника свободной энергии химическую энергию окислительно-восстановительных процессов, живая природа не только получила надёжный и универсальный источник энергии, но и удобный инструмент саморегуляции элементарных биоэнергетических процессов.
3.5. Механизм сопряжения окисления и фосфорилирования.
Удачный выбор источника химической энергии ещё не достаточен для обеспечения энергетических потребностей всех внутриклеточных процессов. Необходим столь же удачный выбор способа и инструментария преобразования энергии окислительно-восстановительных реакций в энергию, удобную для использования в разнообразных элементарных процессах. То, что фосфатные макроэрги в АТФ и АДФ играют основную роль в этом распределении энергии, стало общепринятым ещё в середине 20 века. Но как окисление глюкозы предаёт высвобождаемую энергию в эти макроэрги? Химический механизм сопряжения первых этапов гликолиза с фосфорилированием описан в предыдущем разделе. А каков механизм заключительной стадии окисления НАДН, обеспечивающей основной выход АТФ? Ответ на этот вопрос очень важен не только для биологии, но и для физики. Ведь коэффициент преобразования энергии в митохондриях, как мы видели, значительно превосходит тот, который характерен для известных технических устройств.
В начале исследования этого механизма выдвигаемые гипотезы формировались в две группы: химическую и конформационную.
Сторонники химической гипотезы, к которым относилось подавляющее число исследователей, отталкивались от прецедента субстратного фосфорилирования, которое реализуется на предварительных стадиях гликолиза и кратко описано в предыдущем разделе. Это обычная ферментативная реакция между водорастворимыми субстратами. Почему бы подобным реакциям не идти в митохондриях? Однако все попытки зарегистрировать синтез АТФ в пробирке, содержащей Ф, АДФ, НАДН, О2 и все другие возможные участники процесса, выделенные из митохондрий, оканчивались неудачей. Не были также найдены какие-либо высокоэнергичные продукты, которые можно было бы рассматривать как промежуточные переносчики макроэрга. Некоторым участникам этих событий изменяло терпение, и они шли на подтасовки экспериментальных результатов. Уж очень хотелось оказаться первым у финиша этой престижной гонки.
Конформационная гипотеза опиралась на представление о том, что процесс окисления НАДН может привести к формированию локальных напряжений внутренней мембраны митохондрий, запасающих часть энергии, выделяемой в процессе окисления. Затем, возвращаясь к исходному состоянию, мембрана подобно расправляющейся пружине может передать свободную энергию участникам реакции фосфорилирования. Такие изменения структуры митохондриальной мембраны могли бы быть опосредованы, например, каким-либо мембранно-связанным белком. Возможность такого конформационного процесса мы уже обсуждали. Эту гипотезу долго разрабатывала немногочисленная группа биохимиков (П. Боер), но обнаруживаемые конформационные изменения в мембране при окислении субстратов не были достаточно быстрыми, для того чтобы их можно было считать факторами, сопрягающими окисление и фосфорилирование.
На фоне неудач обеих гипотез появилась альтернативная гипотеза, получившая название хемиосмотической. В 1961 году английский биохимик П. Митчел высказал предположение, что для сопряжения окисления НАДН с синтезом АТФ из АДФ и Ф необходима целостность внутренней мембраны митохондрий, т. е. она должна чётко отделять внутреннее пространство митохондрии («матрикс») от цитоплазмы клетки. Это была качественно новая идея. То, что многие ферменты в клетке нормально функционируют только в тесном контакте с мембраной или даже встроены внутрь мембраны, было известно, но топология мембранной системы никогда не считалась важной для протекания биохимических реакций. Гипотеза П. Митчела подчёркивала важность пространственного разделения продуктов окисления и возникновения при этом трансмембранного электрического и концентрационного потенциала. Этот электрохимический потенциал мог бы выступить в качестве промежуточного энергетического фактора, сопрягающего окисление с последующим фосфорилированием.
В сущности П. Митчел впервые предложил рассматривать биохимический реактор как физическую систему. Эта красивая идея оказалась слишком новой и первоначально не была воспринята биохимиками, продолжавшими следовать двум предыдущим гипотезам. Хемиосмотическая гипотеза оставалась практически незамеченной до тех пор, пока сам Митчел, вынужденный по состоянию здоровья на время прекратить научную работу и окунуться в деревенскую жизнь, не возобновил свои исследования и не показал простыми измерениями, выполненными в скромных сельских условиях, что его гипотеза имеет право на существование и не только хорошо объясняет известные факты, но и обладает высокой предсказательной силой. После возникшей многолетней острой дискуссии гипотеза привлекла многих сторонников и стимулировала обширные исследования во многих лабораториях. Через несколько лет, получив подтверждение основных своих позиций, она в 1978 г была отмечена Нобелевской премией. Не останавливаясь подробно на интересной и поучительной истории развития хемиосмотической теории, приведём кратко её основные положения и экспериментальные факты, свидетельствующие в её пользу.
Несколько упрощая, суть гипотезы Митчела можно выразить следующей схемой (рис. 3.9).
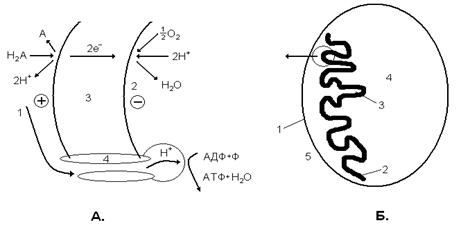
Рис. 3.9. А – Схема окислительно-восстановительного процесса и возникновения электрохимического потенциала на сопрягающей мембране: 1 – цитоплазма, 2 – матрикс, 3 – сопрягающая мембрана, АТФ-синтаза. Б – условный вид сечения митохондрии: 1 – наружная перфорированная мембрана, 2 – внутренняя сопрягающая мембрана, 3 складки внутренней мембраны (кристы), 4 – матрикс, 5 – цитоплазма клетки.
Восстановленный переносчик редокс – потенциала (типа НАДН, ФАДН, восстановленного цитохрома с), обозначенный как АН2, при окислении на внешней стороне мембраны отдаёт свои электроны в цепь переноса электронов и освобождает у внешней грани мембраны 2 иона Н+. Цепь переноса электронов включает локализованные в мембране подвижные переносчики (типа хинонов, растворимых в липидах) и неподвижные белки (типа цитохромов) с различными значениями редокс – потенциалов. Цепь переносит электроны по градиенту редокс – потенциалов к конечному акцептору – кислороду у противоположной грани мембраны. Это спонтанный термодинамически выгодный процесс. Мембрана в нормальном состоянии не проницаема для протонов. В результате на сопрягающей мембране образуется трансмембранный электрохимический потенциал ψ, состоящий из двух частей: электрического потенциала φ (– внутри, + снаружи) и концентрационного потенциала протонов ([Н+] - больше снаружи и меньше внутри):
Ψ = φ + RT/F·ln [H]e/[H]i= φ + 2,3·RT/F·lg [H]e/[H]i = φ - 0,06·ΔрН при Т = 37º С. (3.25)
Здесь ΔрН - это разность показателей кислотности цитоплазмы и матрикса. Изменение кислотности, соответствующее этой гипотезе, означает закисление цитоплазмы и защелачивание матрикса.
Электрохимический потенциал является мерой потенциальной энергии протонов, полученной за счёт разделения мембраной продуктов процесса окисления АН2 и «векторного», т. е. направленного в пространстве переноса зарядов. Время, в течение которого эта энергия может сохраняться, лимитируется изоляционными свойствами мембраны. Главным элементом «утечки» протонов сквозь мембрану является трансмембранный протонный канал в ферменте АТФ-азе, способном вести синтез АТФ за счёт энергии протонного потока. Однако, если есть конкурирующий канал утечки электрического или концентрационного потенциала, то диссипация энергии может сделать невозможной синтез АТФ, т. е. может произойти разобщение окисления и фосфорилирования.
Не останавливаясь подробно на интересной и поучительной истории развития хемиосмотической теории, приведём кратко основные экспериментальные факты, свидетельствующие в её пользу.
Первое важнейшее свидетельство было получено самим Митчелом. Измеряя рН суспензии интактных (целых!) митохондрий в пробирке при внесении в неё субстратов окисления он легко обнаружил закисление среды инкубации, которая заменяла цитоплазму клетки в этом опыте in vitro. Правда, здесь Митчелу сильно повезло. Он использовал воду, не очищенную от ионов Са++. А мембрана митохондрий легко проницаема для них. Электрический потенциал мембраны (+ снаружи!) увлекал ионы кальция внутрь, частично уменьшая заряд мембраны, а с ним и величину φ. Это снимало препятствие при окислении субстрата для дальнейшего протекания электронного тока внутрь и освобождения протонов снаружи мембраны и сдвигало равновесие в сторону увеличения стационарного значения ΔрН. При отсутствии ионов Са++ в используемой воде стационарный сдвиг кислотности становится слишком маленьким для регистрации его простым рН-метром, которым пользовался Митчел. Так химическая небрежность Митчела помогла ему в первом же эксперименте сразу получить важный результат в пользу своей гипотезы. А, разобравшись с ролью ионов кальция, он получил также свидетельства и о возникновении электрического потенциала на мембране, предсказанное его гипотезой. В дальнейшем при необходимости компенсации электрического потенциала или управления им стали пользоваться введением в среду ионов К+ и искусственным переносчиком их через мембрану – антибиотиком валиномицином. Эти опыты, а также опыты с использованием синтетических ионов разного знака полностью подтвердили возникновение на мембране и концентрационного протонного потенциала, и электрического потенциала предсказанной Митчелом полярности.
Возникновение на сопрягающей мембране электрического потенциала было подтверждено также с помощью потенциалочувствительных флуоресцентных меток и измерением электрохромного эффекта в оптических спектрах поглощения компонентов мембраны, обусловленного эффектом Штарк (Х. Витт).
Второе важнейшее следствие из гипотезы Митчела: это естественное объяснение механизма действия так называемых разобщителей. Это большой класс химических соединений разнообразной природы, способных блокировать синтез АТФ при нормально протекающем окислении обычных субстратов. Митчел предположил, что блокирующее действие разобщителей состоит в том, что они делают мембрану проницаемой для протонов. При этом протонный потенциал расходуется на создание «тока короткого замыкания», и АТФ-азная синтезирующая машина обесточивается. Многочисленные эксперименты с природными и синтетическими мембранами подтвердили эту версию. Теперь разобщающую способность любого вещества можно определить в простом эксперименте по его способности увеличивать протонную проводимость фосфолипидной мембраны.
Естественное объяснение в рамках хемиосмотической гипотезы получил и известный феномен холодового разобщения окисления и фосфорилирования. Он состоит в том, что у теплокровных организмов наряду с «дрожательным» термогенезом, т. е. выделением тепла в ответ на охлаждение за счёт бесполезной диссипации энергии гидролиза АТФ при мышечной дрожи, есть другой механизм разогрева за счёт тривиального выделения тепла при протекании окисления с отключённым фосфорилированием. Оказалось, что в митохондриях клеток бурого жира, которые как радиаторы окутывают кровеносные сосуды, ведущие в головной мозг, содержится особый белок – термогенин, способный в своей активной форме переключать дыхание на холостой ход и превращать протонный потенциал сопрягающей мембраны в обычное джоулево тепло. Активатором термогенина являются жирные кислоты, которые образуются из бурого жира с помощью фермента липазы. Бурый жир является одновременно и дополнительным субстратом окисления. Липаза же активируется в свою очередь цепочкой процессов, включаемой гормоном норадреналином. А появление в крови норадреналина является ответным сигналом организма на срабатывание холодовых рецепторов кожи. Этот механизм внутреннего подогрева тканей организма и в первую очередь крови, омывающей головной мозг, очень эффективен: 1 кг бурого жира у подготовленного (в результате «закалки»)
организма способен обеспечить мощность тепловыделения около 400 Вт. Этот механизм стал понятен с позиций хемоосмотической гипотезы.
Сопрягающая роль электрохимического потенциала, конвертирующего энергию окисления топливных субстратов, была продемонстрирована рядом опытов, в которых для создания потенциала на мембране был использован альтернативный источник энергии. Так например, выдерживание суспензии митохондрий в среде с большой концентрации ионов калия через достаточное время приводит к возрастанию концентрации К+ в матриксе митохондрий. Этот процесс можно значительно ускорить, добавив в среду антибиотик валиномицин, который встраивается в мембрану и многократно увеличивает трансмембранную проницаемость ионов калия. Если затем перенести митохондрии в безкалиевую среду, то ионы К+ начнут выходить наружу, унося с собой часть положительного электрического заряда матрикса, пока на сопрягающей мембране не установится равновесный для ионов калия нернстовский потенциал. Его полярность (минус внутри) как раз соответствует знаку митчеловского электрохимического потенциала. Оказалось, что при наличии в среде достаточного количества АДФ и Ф эти энергизованные таким необычным способом митохондрии способны вести синтез АТФ безо всякого субстрата окисления (Б. Прессман).
Было установлено также, что в фотосинтетическом аппарате растений мембрана тилакоида (подробнее об этом – позже) является сопрягающей. Аналогичными свойствами обладает и фотосинтетическая мембрана у фотосинтезирующих бактерий, у которых она расположена под наружной клеточной оболочкой. Электрохимический потенциал здесь создаётся за счёт энергии света. Однако и в этом случае источник его создания можно заменить другим. Если выдержать тилакоиды в кислой среде, так чтобы их внутренность закислилась, а потом перенести их в щелочную среду, то на мембране возникнет электрохимический потенциал протонов нужной полярности (фотосинтетическая мембрана вывернута наизнанку относительно мембраны митохондрий). При прочих благоприятных условиях он обеспечивает синтез АТФ без света (А. Ягендорф).
Важное подкрепление гипотезы Митчела было получено в опыте с так называемой химерой (Р. Ракер и К Стокениус). Был синтезирован искусственный «организм»: в мембрану липосомы (пузырёк в воде), состоящую из фосфолипидов сои, был встроен комплекс АТФ – синтазы из митохондрий сердца быка и светопреобразующий комплекс - бактериородопсин из солелюбивых бактерий (об этом подробнее – позже). Бактериородопсин является известным протонным фотонасосом, который, находясь в мембране бактерий, под действием света выкачивает ионы водорода из цитоплазмы бактерий наружу. Все три компоненты этого устройства являются представителями разных биологических царств: растений, животных и микроорганизмов и никогда не встречались в такой компании. Поэтому их комбинация и получила такое название. Если ориентация компонент в мембране соответствует гипотезе Митчела, то при освещении этого устройства светом и при наличии в липосоме АДФ и Ф в ней синтезируется АТФ.
В 1978 г. П. Митчел за свою гипотезу, которая без преувеличения революционизировала биоэнергетику, был удостоен Нобелевской премии. Но если идея о фундаментальной роли протонного потенциала в сопряжении окисления и фосфорилировании к этому времени была признана большинством исследователей, а механизм образования мембранного потенциала легко объяснился направленным (и при том, противоположным) трансмембранным переносом электронов и протонов, то вопрос о молекулярном механизме преобразовании электрохимической энергии мембраны опять в химическую ещё долго оставался предметов исследований и дискуссий. Представления самого Митчела о возможном механизме фосфорилирования оказались не вполне удачными. Потребовалось ещё много лет для того чтоба молекулярная модель фосфорилирования получила осязаемые очертания.
Не останавливаясь на истории этих исследований, констатируем сегодняшние представления. Митохондриальная АТФ-аза представляет собой белок, состоящий из двух блоков: условно говоря, ножки F0, пронизывающей мембрану, и шляпки F1, примыкающей к ножке со стороны матрикса (рис 3.9.А).
Внутри ножки этого «гриба» есть канал, по которому протоны с внешней (цитоплазматической) стороны мембраны под действием электрохимического потенциала устремляются внутрь митохондрии, где встречаются со шляпкой. Под действием напора потока протонов в субъеденицах шляпки возникают конформационные изменения, которые заставляют шляпку вращаться вокруг общей оси гриба, совершая химическую работу по синтезу АТФ из АДФ и Ф. Схема устройства этого фермента показана на рис. 3.10.

Рис. 3.10. Комплекс F1,F2 АТФ – синтазы. М – матрикс, С – межмембранное пространство, обращённое к цитоплазме.
ногие детали работы этой молекулярной машины пока неизвестны, но её принцип работы понятен. Успехи в изучении устройства этого фермента и общей схемы работы были также увенчаны Нобелевской премией. Важно отметить, что эта машина способна работать обратимо: если электрохимический протонный потенциал превышает необходимый для синтеза АТФ при текущих значениях активностей АДФ, Ф и АТФ идёт синтез АТФ, если нет, то, наоборот, за счёт гидролиза АТФ протонный потенциал на мембране нарастает до равновесного значения.
(φ - 0,06·ΔрН)е = (30.4 + RT·ln {[АТФ]/[АДФ]·[Ф]}) кДж. (3.26)
Следует отметить ещё одно важное физическое свойство мембранного потенциала. В состоянии термодинамического равновесия потенциал должен быть одинаков по всей поверхности мембраны. Характерное время выравнивания электрического потенциала определяется максвелловским временем, зависящим от электрофизических свойств среды и геометрии системы. Оценкой его является отношение диэлектрической постоянной к удельной электропроводности: ε/σ. В водной фазе ε не превышает 80ε0=8*10-11 Ф/м, а в примембранном слое, где вода сильно структурирована, ещё меньше. Удельная проводимость цитоплазмы приблизительно σ = 0,1 Сим/м. Это даёт для характерного времени величину не превышающую по порядку наносекунды. Учёт реальной геометрии несколько увеличит её, но она остаётся достаточно малой величиной. Характерное время выравнивания диффузионного потенциала определяется временем диффузии ионов водорода вдоль поверхности мембраны, которую можно оценить как х2/D. Величины смещения не превышает размера митохондрии, т. е. <10-6м, коэффициент диффузии D протонов в структурированной воде порядка 10-4м2/сек, поэтому характерное время латерального диффузионного выравнивания активности ионов водорода < 10 нм. Следовательно, за время в несколько наносекунд электрохимический потенциал равномерно «размажется» по всей мембране, независимо от того, в каком месте он возник. Это создаёт благоприятную возможность быстрого обеспечения энергией участков клетки, удалённых от места генерации потенциала. Такая передача энергии занимает значительно меньше времени, чем диффузия АТФ от места синтеза к месту его потребления, если они почему-либо разделены. Действительно, было обнаружено, что в мышечных волокнах митохондрии имеют форму не изолированных эллипсоидов, как это обычно представляли, а сильно вытянутых структур, соединённых между собой своими торцами, и образующих целую систему трубок (электрических «кабелей»), охватывающую весь объём мышечного волокна (рис. 3.11).
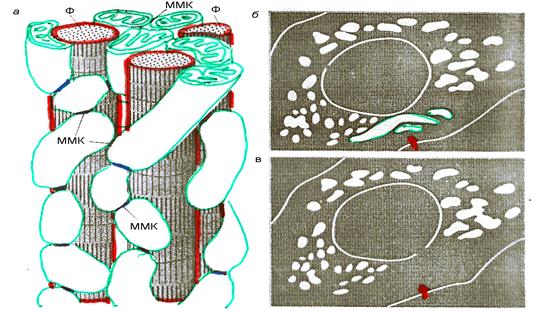
Рис. 3.11.Энергосистема в мышце. а - схема расположения митохондрии и миофибрилл (Ф); ММК - межмитохондриальные контакты; б - флуоресцирующие митохондрии в изолированной клетке, стрелкой указана одна из митохондрий перед облучением, в - та же клетка после облучения (исчез потенциал и погасла флуоресценции целой группы митохондрий, связанных друг с другом с помощью ММК).
Похожий процесс передачи потенциала по сопрягающей мембране на значительные расстояния (вплоть до миллиметра!) был обнаружен и у многоклеточных фотосинтезирующих цианобактеририй – трихом. Клетки этой бактерии соединены последовательно в длинную цепь и способны передвигаться по твердой поверхности вдоль своей оси, подобно дождевому червю. Источником энергии при этом служит свет, создающий электрохимический потенциал протонов на мембране, прилегающую изнутри к внешней оболочке клетки. Оказалось, что в торцах клеток, которыми они скрепляются друг с другом, имеются маленькие сквозные отверстия, через которые потенциал мембраны выравнивается по всей цепочки клеток. При этом генерация потенциала в отдельных клетках при освещении их светом моментально размазывается по всей бактерии, обеспечивая энергией каждую клетку. В опытах с цианобактериями был обнаружен также неожиданный эффект: оказалось, что движение бактерий происходит без участия АТФ, а непосредственно за счёт энергии протонного потенциала на мембране! Этот чрезвычайно важный результат лишает АТФ права на монополию в биоэнергетике клетки и даёт повод задуматься о более общем значении протонного потенциала, чем ему отводилось в гипотезе Митчела изначально. Но прежде, чем перейти к такому обобщению, вернёмся к процессам в митохондриальной мембране и уточним некоторые детали.
Схема работы сопрягающей мембраны, показанная на рис. 3.9А. конечно сильно упрощена. Этот рисунок преследует цель показать аналогию сопрягающей мембраны с топливным элементом, известному физикам, который способен окислять топливо (например. водород), подводимый к одному электроду, окислителем (например, кислородом), подводимым к другому электроду. Разность окислительно-восстановительных потенциалов этой редокс пары реализуется в виде электродвижущей силы для внешней электрической цепи.
Эта аналогия вполне правомерна. Однако на самом деле путь электрона через мембрану более сложен. Он пересекает мембрану трижды пока доберётся до кислорода, В свою очередь протоны тоже переносятся через мембрану в нескольких местах в виде нейтральных соединений на обратных участках перемещения электронов. Поэтому реальная сопрягающая мембрана составлена из параллельно соединённых участков, каждый из которых вносит в свой вклад в суммарный ток через мембрану при электродвижущей силе, составляющей примерно одну треть от полной разности окислительно-восстановительных потенциалов между донором (НАДН2, -0,3 В.) и акцептором (О2 , +0,8 В.). Реально наблюдаемая величина мембранного потенциала близка этому ожидаемому значению ~0,35 В. Более полная схема движения электронов и протонов представлена на рис. 3.12.

Рис. 3.12. переносчики электронов и протонов в митохондриальной мембране. Здесь FeS – железо-серные белки, CoQ – убихиноны (хиноны с углеводородным хвостом, позволяющим хинону растворяться и свободно диффундировать в мембране), CoQH и CoQH2 – полу- и полностью восстановленные его формы, цитохромы Cyt b, c1, ca, ca3 – белки, содержащие гемовое железо, локализованные в мембране, Cyt c – водорастворимый цитохром.
Соотношения вклада электрической и диффузионной доли в общую величину электрохимического потенциала различаются у разных клеток и организмов. Но для энергетики синтеза АТФ с позиций гипотезы Митчелла важна лишь их сумма. Поскольку химическое сродство реакции синтеза АТФ в физиологических условиях составляет (см. формулу 3.14) 11,4 ккал/М или 47,5 кДж/М, а это соответствует около 0,5 эВ на одну молекулу, то, зная величину мембранного потенциала, легко сделать вывод, что для синтеза одной молекулы АТФ.через грибок АТФ-синтазы должно пройти как минимум 2 протона., Действительно, различные АТФ-синтазы используют 2-3 протона при синтезе одной молекулы АТФ. Такой высокий коэффициент полезного действия АТФ-азной машины впечатляет, но не удивляет. Ведь ограничения на коэффициент преобразования энергии, которое накладывает теорема Карно, распространяется только на тепловые циклы.
Полезно оценить также суммарный трансмембранный электронный (и равный ему протонный) ток, который протекает через мембраны всех митохондрий человека. Если вспомнить, что мощность основного метаболизма человека средней упитанности примерно 70 Вт, а более 90% энергетики организма обеспечивается за счёт митохондриального окисления, то, приняв за ЭДС.цепи переноса величину 1,1 вольт, легко получить для тока значение 65 Ампер. При совершении какой-либо простой работы этот ток уже превышает 100 Ампер.
3.6. Энергетическая система живой клетки
Эксперименты, подобные приведенным выше навели на мысль, что роль электрохимического потенциала вероятно шире, чем просто как временное
хранилище свободной энергии для синтеза АТФ. Это предположение получило обширное подтверждение. Оказалось, что энергия протонного потенциала непосредственно обеспечивает без посредничества АТФ большой класс биофизических процессов. Некоторые из них перечислены на рис.3.13. В качестве интересного примера можно привести молекулярный 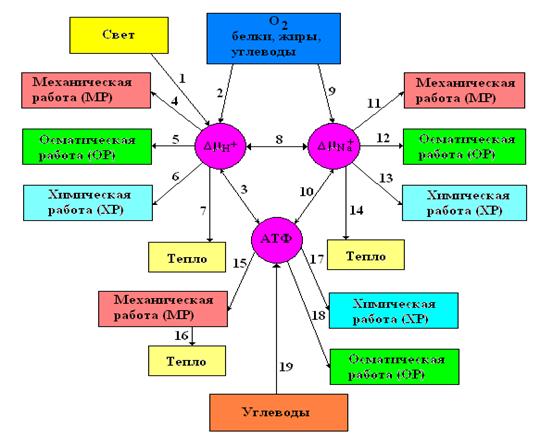
Рис. 3.13. Взаимосвязь источников, носителей и потребителей свободной энергии в клетке.
мотор, приводящий в движение жгутик бактерии. В основании жгутика в мембране находится «ротор», который приводится во вращение потоком протонов из наружной среды в цитоплазму бактерии. На перенос по электрохимическому потенциалу 200-300- протонов ротор совершает один оборот. Коэффициент полезного действия такого мотора довольно близок к единице. Оказалось, что во многих случаях клетка в качестве аккумуляторов и преобразователей энергии использует не ионы водорода, а ионы натрия. Их во внеклеточной среде гораздо больше, чем ионов водорода, поэтому энергетическая ёмкость таких устройств может быть выше чем протонных. Разнообразие фундаментальных носителей энергии и множество биофизических способов их использования позволяет представить новую структуру энергетической системы клетки (рис. 3.13.), в которой АТФ уже лишена своей прежней монополии.
На рисунках 3.14.- 3.17. приведены схемы взаимосвязи различных видов свободной энергии в клетках различных организмов.
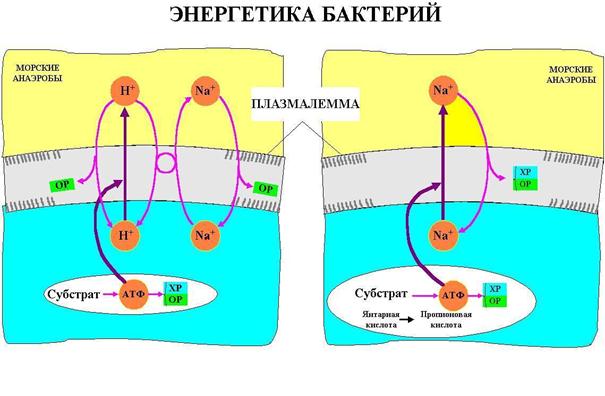
Рис. 3.14. Морские анаэробные бактерии

Рис.3.15. Морские аэробные бактерии.

Рис.3.16. Энергетика животной клетки.

Рис.3.17. Энергетика растительной клетки.
Подводя итоги данного раздела, можно, следуя В.П. Скулачеву, сформулировать законы биоэнергетики:
- Живая клетка избегает прямого использования энергии внешних ресурсов для своих внутренних нужд. Она сначала конвертирует её в одну из трёх форм: макроэрг АТФ, электрохимический потенциал протонов или электрохимический потенциал ионов натрия, которые затем использует для осуществления различных энергопотребляющих процессов.
- Любая живая клетка всегда располагает как минимум двумя формами «энергетической валюты»: водорастворимой (АТФ) и связанной с мембраной.
- Энергетические валюты могут превращаться друг в друга. Поэтому получения хотя бы одной из них за счёт внешнего ресурса достаточно для поддержания жизнедеятельности клетки.
|
|
|
|
|
Дата добавления: 2014-12-26; Просмотров: 841; Нарушение авторских прав?; Мы поможем в написании вашей работы!