
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основы биоэнергетики
|
|
|
|
3.1. Природные источники свободной энергии.
Для поддержания состояния устойчивого неравновесия живой организм, очевидно, нуждается в постоянном притоке свободной энергии. К важным особенностям живых систем, помимо уже упомянутых в предыдущем разделе, следует отнести способность самостоятельно извлекать свободную энергию из внешних источников в форме, пригодной для внутриклеточных процессов. Окружающая природа богата источниками энергии, однако, далеко не все они удовлетворяют требованиям эффективности и доступности для живых организмов.
Прежде всего, они должны позволять совершать работу в весьма ограниченном температурном интервале. Это сразу исключает в качестве основных источников биоэнергии резервуары тепла. Разумеется, внешние источники тепла могут использоваться для поддержания оптимальной температуры живого организма наряду с внутренними теплогенераторами, но их эффективность как источника подходящей свободной энергии ограничена теоремой Карно (см. формулу 2.2). На микроскопических размерах живой клетки невозможно создать и удерживать достаточную разность температур между «нагревателем» и «холодильником», необходимую для сколь-нибудь заметного коэффициента преобразования.
Нельзя использовать энергию ядерных реакций из-за разрушительного влияния ионизирующего излучения на биоструктуры. Так, абсолютно смертельная для большинства теплокровных животных доза γ-радиации 10 Грей несёт энергию всего лишь10 мДж на 1 грамм биомассы (что способно поднять её температуру на ничтожную величину 2.10-3 градуса).
Невозможно в принципе использовать гравитационную энергию в непрерывном процессе и практически невозможно даже на отдельных этапах жизненного цикла из-за ничтожно малого потенциала энергии тяготения на микроскопических размерах клетки.
Проблематично также использование энергии внешних электрических, магнитных и электромагнитных полей радиочастотного диапазона. Энергия статических полей не может быть использована по тем же причинам, что и гравитационная энергия. Потенциальная энергия электрических зарядов в электрическом поле может быть реализована только при смещении зарядов, а оно ограничено и не может обеспечить непрерывного заимствования энергии от внешнего источника. Это же относится и к вращению магнитных диполей в живой клетке во внешнем статическом магнитном поле. Прецессия элементарных магнитных моментов, вызванная приложением магнитного поля, затухает, и устанавливается их равновесное распределение между двумя крайними уровнями энергии, соответствующими ориентации диполей по полю и против него. На этом преобразование энергии заканчивается. Переменные электрические и магнитные поля, вызывая периодические изменения в распределении зарядов или диполей, в принципе могли бы непрерывно поставлять энергию в клетку. Но природные переменные электромагнитные поля весьма слабы и нестабильны для того, чтобы стать надёжным источником энергии. Конечно, это не исключает возможности их управляющего воздействия на процессы в живой системе, но это уже относится к другой проблеме.
Столь же нереально использование механической энергии деформации материалов окружающей среды. В напряжениях элементов земной коры сосредоточены гигантские запасы свободной энергии. Энергия крупномасштабных деформаций периодически выделяется при землетрясениях, но она не может быть использована живыми организмами из-за несоответствия размеров источника и приёмника деформационной энергии. Энергия же микромасштабных деформационных напряжений на подходящих для клетки атомно-молекулярных размерах является в сущности уже разновидностью химической энергии.
Неживая часть биосферы богата химической энергией. Неорганические вещества биосферы не находятся в химическом равновесии между собой и хранят громадные запасы энергии. Однако соответствующие химические реакции кинетически заторможены. Их реализация и получение энергии даже в виде тепла невозможно без катализаторов или физической (например, тепловой) активации реакций. Возможные химические реакции образуют чрезвычайно разнородное множество. Запуск этих реакций и особенно преобразование их энергии в вид пригодный для реализации живой клеткой её биологических функций потребовал бы наличия в клетке соразмерно огромного множества разнородных ферментных комплексов типа молекулярных машин, что практически невозможно. Но именно в химическом потенциале биосферы сосредоточен основной запас свободной энергии, перспективной для живых систем. И природа нашла выход из этой ситуации. Она выбрала в качестве источника биоэнергии один, но очень широкий класс химических процессов, а именно, окислительно-восстановительные реакции. В класс субстратов этих реакций входит огромное количество химически разнородных соединений и элементов, объединённых способностью к одному элементарному акту их взаимодействия: переносу электрона от одного субстрата (донора электрона) к другому (акцептору электрона). Часто это сопровождается практически одновременным переносом протона. Энергия, выделяющаяся при спонтанном протекании окислительно-восстановительной реакции, в принципе может быть сохранена в той или иной форме свободной энергии, если перенос зарядов осуществляется с помощью специально устроенного ферментного комплекса («молекулярной машины»). А поскольку процессы переноса элементарных зарядов в различных донорно-акцепторных парах во многом похожи друг на друга, реализация окислительно-восстановительных процессов в большом множестве элементов и соединений может быть обеспечена сравнительно небольшим набором ферментных комплексов. Продукт окислительно-восстановительных превращений различных веществ может быть универсальным и в свою очередь может служить источником энергии для разнообразных биологически важных процессов в живой клетке. В отличие от преобразователя типа тепловой машины такое устройство может иметь высокий коэффициент преобразования свободной энергии, не ограниченный теоремой Карно (2.2). Очевидно, что реализация живой системой такого механизма получения свободной энергии из окружающей среды даёт ей огромные преимущества. И эволюция биоэнергетических механизмов живой природы пошла именно по этому пути.
Следует отметить также большую привлекательность лучистой энергии Солнца в качестве практически неисчерпаемого источника свободной энергии. Энергия квантов солнечного света в видимом диапазоне излучения (400-700 нм.) 1,7 – 3 электрон-вольта хорошо соответствует прочности типичных химических связей. В отличие от ионизирующей радиации она не столь велика, чтобы разорвать основные структурообразующие химические связи в клетке, но достаточна для электронного возбуждения некоторых молекул. Если возбуждённые степени свободы достаточно - долгоживущие в указанном ранее смысле (т. е. имеют большое время тепловой релаксации), то эта энергия может быть преобразована в некоторую полезную форму свободной энергии, прежде чем превратится в тепло. Возбуждение светом электронных степеней свободы молекулы изменяет её окислительно-восстановительный потенциал и может стимулировать соответствующие реакции, легко сопрягающиеся с системой других окислительно-восстановительных превращений, имеющейся в клетке. Таким образом, физические механизмы преобразования световой энергии и энергии окислительно-восстановительных реакций могут в принципе естественным образом создать единую биоэнергетическую систему живой клетки. Как мы увидим дальше, живая природа широко использовала эту возможность.
«Механическая», деформационная энергия на молекулярном масштабе также тесно связана с этой биоэнергетической системой. Действительно, если молекула имеет равновесную геометрическую структуру расположения ядер своих атомов, (равновесную конформацию), соответствующую состоянию своей электронной подсистемы, то изменение последней, вызванное окислительно-восстановительной реакцией или оптическим возбуждением, превращает конформацию молекулы в неравновесную, механически напряжённую. Это побуждает ядерную подсистему начать движение к новому равновесному положению. Одновременно изменяют своё положение и окружающие данную молекулу элементы среды, способные к электрической поляризации (процесс «пересольватации»). Для маленьких молекул и отдельных атомов в сильно полярной водной среде эта энергия «реорганизации среды» достигает 1-1,5 эВ. Для больших молекул этот вклад не столь значительный, но конформационная энергия может быть весьма существенной. Перестройка ядерной подсистемы происходит, в сущности, за счёт энергии электронной подсистемы и поэтому вызывает изменение величины окислительно-восстановительного потенциала молекулы, что в свою очередь изменяет её реакционную способность и величину соответствующего химического сродства. Это интересное «нелинейное» явление может лежать в основе некоторых процессов самоорганизации и саморегуляции. Если новое электронное состояние достаточно долгоживущее, то процесс реорганизации может пройти до конца. Характерная продолжительность этого процесса зависит от структуры, размера молекулы и от её взаимодействия с окружением. Для изменения конформации большой молекулы фермента в целом может потребоваться время от миллисекунд до секунд. Для перестройки структуры в непосредственной близости от реакционного центра может быть достаточно и пико- или наносекунд. Энергия, выделяемая при конформационной перестройке, может полностью перейти в тепло, но в специально устроенных молекулярных машинах может использоваться для совершения механической работы или химических реакций. Таким образом, энергия механической деформации макромолекул может хорошо сопрягаться с биоэнергетической системой клетки и служить её естественной составной частью. Отдельные примеры этому мы увидим в дальнейшем, но в целом эта сторона биоэнергетики изучена пока недостаточно.
3.2. АТФ и макроэргическая фосфатная связь
По мере развития количественных методов исследования в биологии и расширения объектов биофизических исследований в поле зрения биофизики естественно попали проблемы преобразования энергии в живых системах. С начала тридцатых годов и до конца двадцатого века проблемы биоэнергетики наряду с проблемами молекулярной генетики были основными объектами биологической науки. Начинаясь как чисто биохимические, эти исследования со временем приобретали всё более биофизический характер и к концу века завершились фундаментальными биофизическими результатами.
В тридцатые - пятидесятые годы прошлого столетия было установлено, что химическая энергия пищевых субстратов переводится в химическую энергию связей неорганического фосфата (Н3РО4) в составе молекул аденозинтрифосфата (АТФ), аденозиндифосфата (АДФ) и аденозинмонофосфата (АМФ) и используется для обеспечения элементарных процессов в клетке при гидролизе фосфатных связей, что процесс образования этих связей («фосфорилирование») сопряжён с реакциями окисления сахаров в клетках животных и бактерий, а также с процессом утилизации световой энергии в растениях и водорослях (В.А. Энгельгардт, Ф. Липман, Д. Арнон и др.). Фосфатные связи, хранящие эту энергию, получили название «макроэргических». Последующие интенсивные исследования сотен учёных всего мира были направлены на уточнение и конкретизацию этих представлений и, главное, на изучение механизма сопряжения окисления «топливных» субстратов и реакции фосфорилирования.
Но прежде, чем ознакомиться с итогами изучения механизмов окислительного фосфорилирования, увенчанных несколькими Нобелевскими премиями, остановимся на физическом смысле макроэргической связи. Действительно, если макроэргическая фосфатная связь богата энергией (а при её гидролизе в стандартных условиях выделяется свободная энергия 7,3 ккал (30,4 кДж) на моль связей или 0,316 эв. на одну связь), она, казалось бы, должна быть нестабильной и спонтанно разрываться. Однако на самом деле это достаточно стабильная связь, и молекулы АТФ, как и АДФ и АМФ, - реально существующие химические соединения. Однако фосфатная связь может стать ещё более стабильной, если фосфатную группу перенести на другой акцептор. Эта ситуация условно изображена на рис.3.1, где энергия системы показана в функции от обобщённой координаты реакции отделения фосфатной группы от молекулы АТФ.
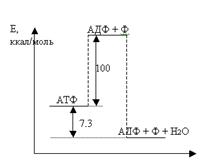
Рис. 3.1. «Макроэргическая» связь в АТФ. По горизонтальной оси - обобщённая координата процесса.
Отрыв фосфатной группы от остова молекулы АТФ с образованием изолированных продуктов в вакууме требует энергии около 100 кк на моль, и в этом отношении молекула АТФ вполне устойчива. Однако, если после этого умозрительного процесса фосфатную группу перенести на воду, то новая система станет ещё более стабильной, чем исходная. Разница в энергии составит 7,3 кк (или 30,4 кДж) на моль. Это и есть энергия гидролиза. В реальной водной среде живой клетки энергетический барьер, разделяющий два состояния, несколько меньше 100 кк/М, но он достаточен, чтобы кинетически затормозить спонтанный процесс гидролиза. Это важное обстоятельство, т. к. оно исключает бесполезную диссипацию энергии и позволяет направить её в целесообразные для клетки реакции, контролируемые соответствующими ферментами. Именно специальная конструкция фермента может в принципе обусловить преобразование энергии и обеспечить сопряжение гидролиза с другими процессами. Это же относится и к обратному процессу фосфорилирования: только специально устроенный фермент может обеспечить запасание энергии экзогенных процессов в форме макроэрга АТФ. Молекула АТФ не единственный обладатель макроэргической фосфатной связи. Достаточно часто используются макроэрг АДФ. Условно это изображают так:
АТФ + Н2О = АДФ + Ф +Н++ 7.3 кк/М (30,4 кДж/М) (3.1)
АДФ + Н2О = АМФ + Ф + Н++7,3 кк/М (3.2)
Здесь Ф обозначает ортофосфат, который в водной среде клетки при нормальных условиях ионизован и имеет вид НРО42-. Ионизованы и молекулы АТФ, АДФ и АМФ. Они имеют при нейтральном значении рН в клетке отрицательные заряды 4, 3, и 2 единицы, соответственно. Выделяемая в реакции энергия (иначе, сродство процесса), показанная в уравнениях реакций, относится к стандартным условиям, т. е. активностям реагентов в 1 М/л., нейтральному значению рН и очень разбавленным растворам(когда активность воды, т.е. её мольная доля, также равна единице). Реальные активности могут значительно отличаться от стандартных и величину сродства при этом нужно рассчитывать по формуле (2.58). Иногда для краткости в записи этих реакций опускают воду и ионы водорода, но об их участии в гидролизе не следует забывать. Рассмотрение точных химических формул участников рассматриваемых процессов не входит в задачи нашего предмета, но АТФ заслуживает исключения. В основе устройства молекулы АТФ лежит сахар рибоза, который связывает в единое целое три остатка фосфорной кислоты с оной стороны и азотистое основание аденин с другой (рис. 3.2).
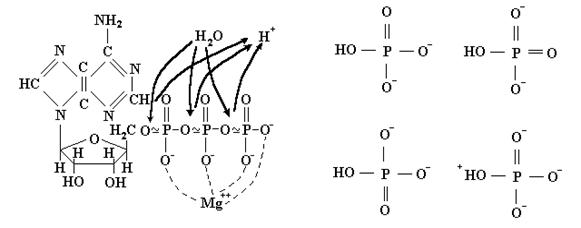
Рис. 3.2. Слева – структура молекулы АТФ. Знаками ~ обозначены макроэргические связи. Жирными стрелками показаны места присоединения молекул воды и отщепления ионов водорода при реакции гидролиза. Пунктиром указаны места координирования ионов Mg++ или Mn++. Справа – возможные “резонансные” формы фосфатного иона в водном растворе, отвечающие за 4-х кратное вырождение диссоциированного состояния.
Принято считать, что относительно высокое значение макроэрга в АТФ и АДФ обусловлено двумя физическими факторами: множественностью форм ортофосфата в воде и электростатическим отталкиванием фосфатных групп в исходных молекулах. Действительно, заряды в ионе НРО42- могут быть распределены по атомам кислорода четырьмя разными способами. Это увеличивает вероятность диссоциированного состояния, а с нею и сродство реакции гидролиза. Этот выигрыш нетрудно оценить (см. формулу 2.58): при температуре 37 ˚С
ΔА = RТ·ln 4 =0,86 кк/М или 0,037 эв. (3.3)
Это немногим более 10℅. от величины макроэрга.
Второй фактор более значителен. Об этом говорит тот факт, что при гидролизе последней фосфатной группы в АМФ, когда вклад электростатических сил значительно снижен, изменение свободной энергии снижается до 3,3 кк/М. Вообще энергия гидролиза зависит от структуры молекулы, от которой фосфатная группа отщепляется. Если для унификации взять воду как общий акцептор для переноса фосфатных групп от различных доноров, то можно построить шкалу потенциала переноса группы, которая позволяет определить энергетическую возможность взаимного переноса фосфатной группы между различными соединениями (таблица 3.1). Из таблицы видно, что спонтанный перенос фосфатной группы при стандартных условиях возможен между соединениями только по направлению сверху вниз, Обратный же перенос энергетически возможен лишь при нестандартной стехиометрии. Например, перенос одной фосфатной группы от глюкозо-1-фосфата на креатин теоретически возможен при гидролизе как минимум двух молекул глюкозо-1-фосфата.
Таблица 3.1.
| Соединение | Сродство (потенциал переноса), кк/М |
| Фосфоэнолпируват | 14,8 |
| 1,3-бисфосфоглицерат | 11,8 |
| Ацетилфосфат | 10,3 |
| Креатинфосфат | 10,3 |
| Пирофосфат | |
| АТФ | 7.3 |
| АДФ | 7,3 |
| Глюкозо-1-фосфат | 5,0 |
| Глюкозо-6-фосфат | 3,3 |
| АМФ | 3,3 |
3.3. Источники энергии для образования АТФ в клетке.
Общая схема извлечения энергии из топливных субстратов хорошо известна. У гетеротрофных организмов она построена по принципу конвергенции (рис. 3.3): энергия различных топливных субстратов постепенно переводится на общий носитель - ацетил-коэнзим А (ацетил-СоА).
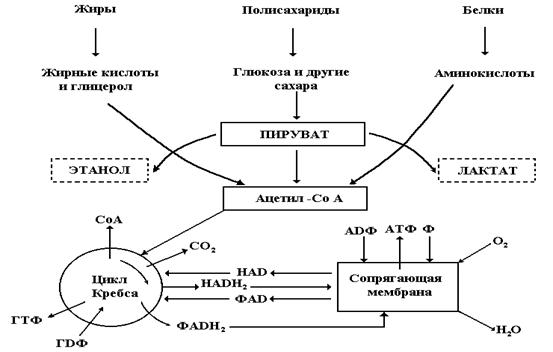
Рис. 3.3. Схема метаболизма топливных субстратов. Стрелками показаны направления химических превращений. На схеме приведены лишь основные метаболиты. НАДН2 и НАД – восстановленная и окисленная формы никотинамидного переносчика, ФАДН2 и ФАД – аналогичные формы флавинового переносчика.
Весь процесс можно разделить на три стадии. Первая стадия носит подготовительный характер, она переводит сложные соединения в более простые и не связана с извлечением энергии. Вторая, продолжая катаболизм, сводит разнообразные продукты первой стадии к ацетильной части ацетил-СоА. Здесь в виде высокого восстановительного потенциала ацетил-СоА сосредоточивается основная часть химической энергии исходных субстратов. В центральной ветви этой схемы, а именно в метаболизме сахаров, вторая стадия заключается в разложении шести углеродной молекулы глюкозы на две молекулы трех углеродного углевода пирувата. Эта реакция, именуемая гликолизом, приводит к окислению некоторых промежуточных продуктов разложения глюкозы, но не требует кислорода. Она проходит с участием других окислителей – широко распространённых в клетке никотинамидных переносчиков редокс-потенциала – НАД (восстановленная форма: НАДН2). Об их свойствах будет рассказано позже. В результате превращения одной молекулы глюкозы в две молекулы пирувата 2 молекулы НАД восстанавливаются до НАДН2, и 2 молекулы АДФ фосфорилируются до АТФ. Эти процессы происходят в цитозоле клетки, а их участники не связаны с какими-либо клеточными структурами. Процесс синтеза АТФ в таких условиях получил название субстратного фосфорилирования. В частности, синтез первой молекулы АТФ катализируется ферментом глицеральдегид-3-фосфат-дегидрогеназой, который сопрягает окисление глицеральдегида (и восстановление НАД до НАДН2) с захватом дополнительной фосфатной группы из раствора на сульфгидридную группу цистеинового остатка своего активного центра. Размещение фосфата в высокоэнергичном положении фермента оказывается возможным за счёт того, что часть энергии окисления глицеральдегида фермент использует для перемещения зарядов в фермент-субстратном комплексе, облегчающим реакцию переноса фосфатной группы. Образовавшийся продукт – 1,3-бисфосфоглицерат (1,3-БФГ) – имеет высокий потенциал переноса второй фосфатной группы и способен уже самопроизвольно передать её на АДФ. Этот процесс катализируется другим ферментом: фосфоглицераткиназой. Описанный процесс является примером передачи энтальпии самопроизвольной реакции окисления, при которой окислительно-восстановительные продукты находятся в различных частях одного молекулярного комплекса, в энтальпию «энергетически невыгодной» реакции другого типа (переноса фосфатной группы) в том же комплексе. Вторая молекула АТФ образуется также в процессе субстратного фосфорилирования, но не за счёт окисления, а в результате дегидратации под действием фермента энолазы. Это также повышает потенциал переноса фосфатной группы в образовавшемся фосфоэнолпирувате (см. таблицу 3.1). Дальнейший перенос фосфата на АДФ имеет уже положительное сродство и ускоряется ферментом пируваткиназой (рис.3.4).
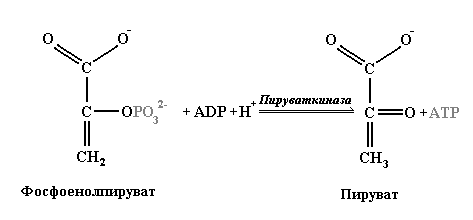 |
Рис.3.4. Реакция субстратного фосфорилирования с образованием пирувата.
Механизмы субстратного фосфорилирования являются классическими примерами термодинамического сопряжения и достаточно хорошо изучены в биохимии.
В анаэробных условиях или в условиях выраженной гипоксии пируват становится центром бифуркации процесса (см. рис. 3). При наличии в клетке фермента алкогольдегидрогеназы (как в клетках дрожжей) пируват может превратиться в этиловый спирт (этанол):
Пируват → Ацетальдегид +СО2. Ацетальдегид + НАДН2 → Этанол + НАД (3.4)
В отличие от этого в клетках животных и в микроорганизмах в этих условиях пируват превращается в молочную кислоту (лактат):
Пируват + НАДН2 → Лактат + НАД (3.5)
Реакция контролируется ферментом лактатдегидрогеназой. В организме животных молочная кислота через некоторое время превращается снова в глюкозу. Если организм совершал большую мышечную работу без достаточного обеспечения мышечной ткани кислородом, то концентрация молочной кислоты в мышцах может некоторое время оставаться на высоком уровне. Это является одной из причин мышечной боли. Закисление внутриклеточной среды (уменьшение рН) при этом является важным сигналом для клетки о степени её функциональной нагрузки. При достаточно большом закислении цитоплазмы начинается активация генома и увеличивается синтез недостающих структурных и регуляторных белков – важные приспособительные (адаптационные) процессы. Реакции (3.4) и (3.5) получили название спиртового и, соответственно, молочнокслого брожения. Обе эти реакции требуют для получения более восстановленного продукта переносчика восстановленного потенциала. Им является НАДН2, полученный на предшествующих стадиях гликолиза. Общая стехиометрия этих двух типов гликолиза выглядит следующим образом:
Глюкоза + 2Ф +2АДФ → 2Этанол + СО2 + 2АТФ + 2Н2О (3.6)
Глюкоза + 2Ф + 2АДФ → 2Лактат + 2АТФ +2Н2О (3.7)
Никотинамидные переносчики редокс-потенциала не вошли в эти итоговые уравнения, т.к. их участие носит промежуточный циклический характер. Важно ответить, что биоэнергетический выход этих реакций ограничивается двумя молекулами АТФ на одну использованную молекулу глюкозы. Это совсем немного, около 2% от исходной химической энергии глюкозы. Правда, продукты этого превращения (этанол и лактат) имеют ещё большой запас энергии, но для её извлечения нужны дополнительные механизмы.
При нормальном напряжении кислорода происходит утилизация ацетил-СоА и открывается новый широкий дополнительный канал убыли пирувата из-за его превращения в ацетил-СоА. Эта третья стадия метаболизма. Она начинается с окисления пирувата до ацетил-коэнзима-А. Простая структура молекулы пирувата (рис 3.4) обладает большим запасом химической энергии. Её вполне достаточно для восстановления молекулы НАД за счёт окисления своей карбонильной группы до СО2 и перенесения оставшейся ацетильной группы (О=С–СН3)–, обладающей также высоким восстановительным потенциалом, на коензим-А. Формула этой реакции выглядит просто (рис. 3.6):
Пируват + СоА + НАД → Ацетил-СоА + СО2 + НАДН2 (3.8)
Однако высокое химическое сродство этой реакции сталкивается с её сильной кинетической затруднённостью из-за того, что её отдельные этапы тормозятся высокими энергетическими барьерами. Поэтому реально процесс (3.8) очень сложен, включает четыре стадии и использует три различных фермента, образующих пируват-дегидрогеназный комплекс. Мы оставим в стороне этот биохимический аспект проблемы и отметим только, что СоА – это сложное органическое соединение, которое способно присоединять ацетильную группу через тиоэфирную связь (рис. 3.5):
|
|
|
|
|
Дата добавления: 2014-12-26; Просмотров: 1473; Нарушение авторских прав?; Мы поможем в написании вашей работы!