
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Общая характеристика. Карбоновые кислоты алифатического ряда
|
|
|
|
Карбоновые кислоты алифатического ряда
Карбоновые кислоты
Кислотный характер карбоновых кислот ярко выражен, так как электроотрицательный кислород карбонильной группы смещает π - электронную плотность таким образом, что на углеродном атоме карбонила появляется заряд +δ. Это вызывает смещение неподеленной пары электронов атома кислорода гидроксильной группы в сторону атома С, что в свою очередь, приводит к перемещению электронной плотности связи О – Нв сторону кислорода. В результате этого облегчается отрыв атома водорода в виде протона – происходит процесс кислотной диссоциации:
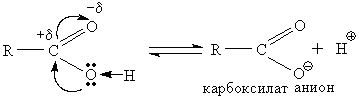
Рентгеноструктурные исследования показали, что в карбоксилат анионе оба кислорода равноценны, электронная плотность в нем распределена равномерно. Схематически это можно представить так:

Сравним константы диссоциации различных кислот:
| Константа диссоциации | ||
| Муравьиная | 
| 2,14 х 10-4 |
| Уксусная | 
| 1,76 х 10-5 |
| Пропановая | 
| 1,33 х 10 -5 |
| Угольная | 
| 4,4 х 10 -7 |
| Фосфорная | 
| 7,6 х 10 -3 |
| Спирт | 
| ~10-18 |
Из таблицы видно, что:
1) органические карбоновые кислоты слабее минеральной Н3Р04, но сильнее угольной Н2СОз. Их кислотные свойства выражены сильнее, чем у спирта;
2) электронодонорные группы (-СН3 и др.) уменьшают кислотность, так как проявляют + Iэф, уменьшая частичный положительный заряд +δ на углероде, подвижность водорода также уменьшается.
Рассмотрим влияние электроноакцепторных групп:
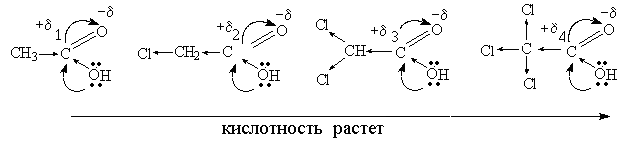
+δ4 >+δ3 > +δ2 > +δ1
Галогены - электроноакцепторные атомы, оттягивая электроны, увеличивают частичный положительный заряд +δ на углероде и, следовательно, подвижность атома_водорода увеличивается.
|
|
|
|
|
Дата добавления: 2014-12-26; Просмотров: 692; Нарушение авторских прав?; Мы поможем в написании вашей работы!