
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кислотные свойства
|
|
|
|
Ароматические карбоновые кислоты
Карбоксильная группа может быть связана с углеродом бензольного кольца или с углеродом боковой цепи:
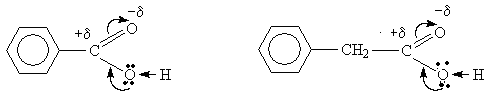
Бензойная кислота Фенилуксусная кислота
По своим свойствам ароматические кислоты идентичны алифатическим; они также образуют ангидриды, галогенангидриды, амиды, эфиры, нитрилы и другие производные (см. учебник Петрова А.А.)
В водных растворах бензойная кислота диссоциирует с образованием стабильного аниона С6Н5СОО- и протона Н+
Сравним константы диссоциации кислот:
| Муравьиная | НСООН | 2,14 x 10-4 |
| Уксусная | СНзСООН | 1,76 x 10-5 |
| Бензойная | С6Н5СООН | 6,6 x 10-5 |
| Угольная | Н2С03 | 4,4 x 10-7 |
| Фосфорная | Н3Р04 | 7,6 х 10-3 |
Из таблицы видно, что бензойная кислота, как и алифатические карбоновые кислоты, слабее минеральных, но сильнее угольной. По степени диссоциации бензойная кислота превосходит уксусную. На константу диссоциации оказывает большое влияние присутствие в кольце заместителя. Например:

Вывод: электроноакцепторной заместитель -NО2 в орто- и пара- положениях увеличивает кислотность. Это объясняется тем, что -NО2 оттягивает электронную плотность из кольца, смещение электронной плотности в карбоксильной группе происходит таким образом, что связь О–Н ослабевает и растетподвижность кислотного протона.
|
|
|
|
|
Дата добавления: 2014-12-26; Просмотров: 1898; Нарушение авторских прав?; Мы поможем в написании вашей работы!