
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Регуляция синтеза белка
|
|
|
|
Г I
Лей <- Орн «- Вал <- Про <- D-Фен
Показано, что именно легкая белковая фракция (молекулярная масса 100000 Да) обеспечивает рацемизирование и включение D-фенилаланина в первую полипептидную цепь, а тяжелая (молекулярная масса 180000 Да) — включение 4 остальных L-аминокислот. Аналогично синтезируется такой же пентапептид на расположенном рядом мультиферментном комплексе, затем оба пентапептида соединяются по типу «голова к хвосту» с замыканием цепи и образованием циклического декапептида. В механизме синтеза предполагается предварительное образование аминоациладени-латов (при участии этих же ферментов), из которых остатки аминокислот затем
переносятся на SH-группы ферментов. Аналогичный механизм синтеза доказан и для декапептида — антибиотика тироцидина и 13-членного циклического пептида — антибиотика микобациллина.
Таким образом, природа (условно в лице бактериальной клетки), очевидно, не утратила полностью существовавший до матричного, рибосомного пути атавистический механизм синтеза белковых тел, пользуясь для этого, может быть, весьма примитивными, но достаточно эффективными приемами.
Основным условием существования любых живых организмов является наличие тонкой, гибкой, согласованно действующей системы регулирования, в которой все элементы тесно связаны друг с другом. В белковом синтезе не только количественный и качественный состав белков, но и время синтеза имеет прямое отношение ко многим проявлениям жизни. В частности, от этого зависит приспособление микроорганизмов к условиям окружающей питательной среды как биологической необходимости или приспособление сложного многоклеточного организма к физиологическим потребностям при изменении внутренних и внешних условий.
Клетки живых организмов обладают способностью синтезировать огромное количество разнообразных белков. Однако они никогда не синтезируют все белки. Количество и разнообразие белков, в частности ферментов, определяются степенью их участия в метаболизме. Более того, интенсивность обмена регулируется скоростью синтеза белка и параллельно контролируется аллостерическим путем. Таким образом, синтез белка регулируется внешними и внутренними условиями, которые диктуют клетке синтез такого количества белка и таких белков, которые необходимы для выполнения физиологических функций. Все это свидетельствует о весьма сложном, тонком и целесообразном механизме регуляции синтеза белка в клетке.
Общую теорию регуляции синтеза белка разработали Ф. Жакоб и Ж. Моно. Сущность этой теории сводится к «выключению» или «включению» генов как функционирующих единиц, к возможности или невозможности проявления их способности передавать закодированную в структурных генах ДНК генетическую информацию для синтеза специфических белков. Эта теория, доказанная в опытах на бактериях, получила широкое признание, хотя в эукариотических клетках механизм регуляции синтеза белка вероятно более сложный. У бактерий доказана индукция ферментов (т. е. синтез ферментов de novo) при добавлении в питательную среду субстратов этих ферментов. Добавление конечных продуктов реакции, образование которых катализируется этими же ферментами, напротив, вызывает уменьшение количества синтезируемых ферментов. Это последнее явление получило название репрессии синтеза ферментов. Оба явления — индукция и репрессия — взаимосвязаны.
Согласно теории Жакоба и Моно в биосинтезе белка у бактерий участвуют по крайней мере три типа генов: структурные гены, ген-регулятор и ген-оператор. Структурные гены определяют первичную структуру синтезируемого белка. Именно эти гены в цепи ДНК являются основой для биосинтеза мРНК, которая затем поступает в рибосому и, как было указано выше, служит матрицей для биосинтеза белка. Регуляция синтеза белка путем индукции представлена на рис. 13.10.
Видно, что синтез мРНК на структурных генах молекулы ДНК непосредственно контролируется определенным участком, называемым геном-оператором. Он служит как бы пусковым механизмом для функционирования структурных генов. Ген-оператор локализован на крайнем отрезке структурного гена или структурных генов, регулируемых им. «Считывание» генетического кода, т. е. формирование мРНК, начинается спромотора — участка ДНК, являющегося точкой инициации для синтеза мРНК, и далее распространяется последовательно вдоль оператора и структурных генов. Координированный одним оператором одиночный ген или группа структурных генов образует о п е р о н.
В свою очередь деятельность оперона находится под контролирующим влиянием другого участка цепи ДНК, получившего название гена-регулятора. Поскольку структурные гены и ген-регулятор находятся в разных участках цепи ДНК, связь между ними, как предполагают Ф. Жакоб и Ж. Моно, осуществляется при помощи вещества-посредника, оказавшегося белком и названного репрессором. Образование репрессора происходит в рибосомах ядра на матрице специфической мРНК, синтезированной на гене-регуляторе. Репрессор имеет сродство к гену-оператору и обратимо соединяется с ним в комплекс. Образование такого комплекса приводит к блокированию синтеза мРНК и, следовательно, синтеза белка, т. е. функция гена-регулятора состоит в том, чтобы через белок-репрессор прекращать деятельность структурных генов, синтезирующих мРНК. Репрессор, кроме того, обладает способностью строго специфически связываться с определенными низкомолекулярными веществами, называемыми индукторами, или эффекторами. Когда такой индуктор соединяется с репрессором, последний теряет способность связываться с геном-оператором, который таким образом выходит из-под контроля гена-регулятора, и начинается синтез мРНК.
Это типичный пример отрицательной формы контроля, когда индуктор, соединяясь с белком-репрессором, вызывает изменения его третичной структуры настолько, что репрессор теряет способность связываться с геном-оператором. Этот процесс аналогичен взаимоотношениям аллостерического центра фермента с эффектором, под влиянием которого изменяется третичная структура фермента и он теряет способность связываться со своим субстратом.
Механизм описанной регуляции синтеза белка и взаимоотношения репрессора со структурными генами были доказаны в опытах на Е. coli, на примере синтеза р-галактозидазы (лактазы) — фермента, гидролизующего молочый сахар на глюкозу и галактозу. Дикий штамм Е. coli, обычно растущий на глюкозе, не может расти, если вместо глюкозы в питательную среду добавить лактозу (новый источник энергии и углерода) до тех пор, пока не будут синтезированы соответствующие ферменты (адаптивный синтез). При поступлении в клетку лактозы (индуктора) молекулы ее связываются с белком-репрессором и блокируют связь между репрессором и геном-оператором. При этом ген-оператор и структурные гены начинают снова функционировать и синтезировать необходимую мРНК, которая «дает команду» рибосомам синтезировать Р-галактозидазу. Одновременно ген-регулятор продолжает вырабатывать репрессор, но он блокируется новыми молекулами лактозы, поэтому синтез фермента продолжается. Как только молекулы лактозы будут полностью расщеплены, репрессор освобождается и, поступив в ДНК, связывает ген-оператор и блокирует синтез мРНК, а следовательно, синтез р-галактозидазы в рибосомах.
Таким образом, биосинтез мРНК, контролирующий синтез белка в рибосомах, зависит от функционального состояния репрессора. Если репрессор, который представляет собой белок, построенный из 4 субъединиц с общей молекулярной массой около 150000 Да, находится в активном состоянии, не связан с индуктором, то он блокирует ген-оператор и синтез мРНК не происходит. При поступлении метаболита-индуктора в клетку его молекулы связывают репрессор, превращая его в неактивную форму (или, возможно, снижая его сродство к гену-оператору). Структурные гены выходят из-под запрещающего контроля и начинают синтезировать нужную мРНК.
Выше было указано, что концентрация ряда ферментов в клетках резко снижается при увеличении концентрации отдаленных конечных продуктов, образующихся в цепи последовательных ферментативных реакций. Такой эффект, получивший название репрессии ферментов, часто наблюдается при реакциях биосинтеза. В этих случаях оказалось, что молекулы репрессора, также образующиеся в рибосомах ядра по «команде» гена-регулятора, являются неактивными и сами по себе не обладают способностью подавлять деятельность гена-оператора и, следовательно, всего оперона, но приобретают такую способность после образования комплекса с конечным или одним из конечных продуктов биосинтетического процесса (рис. 13.11).
Конечный продукт выступает, таким образом, в качестве корепрессора. Имеются данные, показывающие, нто в качестве корепрессоров в синтезе ферментов обмена аминокислот выступает не свободная аминокислота как конечный продукт биосинтетической реакции, а комплекс ее с тРНК — аа-тРНК.
В регуляции экспрессии структурных генов специфическое участие принимает особый белок, получивший название катаболитный ген-активирующий белок (от англ. catabolite gene activation protein, сокращенно обозначаемый САР); этот белок взаимодействует с цАМФ, образуя комплекс, способствующий прикреплению РНК-полиме-разы к промоторному участку генома. В присутствии комплекса САР-цАМФ фермент может начать транскрипцию оперона, включая структурные гены, т. е. в клетках имеется еще один, дополнительный САР-цАМФ регулятор, действующий скорее всего в качестве положительного регулятора, поскольку его присутствие необходимо для начала экспрессии гена. Таким образом, концепции Жакоба и Моно о механизме проявления активности генов признана одним из блестящих достижений молекулярной биологии. Она явилась логическим развитием многочисленных исследований, проведенных генетиками и биохимиками в предшествующие десятилетия.
В заключение следует вкратце рассмотреть вопрос о регуляции процессов диф-ференцировки клеток высших организмов. ДНК, присутствующая во всех соматических клетках, вероятнее всего, имеет одинаковую первичную структуру у данного организма и соответственно располагает информацией для синтеза любых или всех
белков тела. Тем не менее клетки печени, например, синтезируют сывороточные белки, а клетки молочной железы — белки молока. Нет сомнения в том, что в дифференцированных клетках, очевидно, существует тонкий механизм контроля деятельности ДНК в разных тканях, обеспечивающий синтез многообразия белков.
Механизмы, лежащие в основе этой регуляции, пока неизвестны. Для объяснения их имеется ряд гипотез. Предполагается, что контроль осуществляется на уровне транскрипции по аналогии с индукцией ферментов у бактерий и что в этом случае в клетках животных должны функционировать аналогичные репрессоры. Поскольку с молекулой ДНК у эукариот связаны гистоны, считается, что именно они выполняют роль ренрессоров. Однако прямые доказательства их роли в качестве репрессоров отсутствуют, как и точные данные о существовании и природе каких-либо репрессоров в клетках эукариот. Высказано предположение, что в ядре синтезируется гигантская молекула мРНК, содержащая информацию для синтеза широкого разнообразия белков, но в цитоплазму, как было показано выше, попадает только небольшая часть зрелой мРНК, а основная часть распадается. Неясны, однако, биологический смысл и назначение этого механизма избирательного распада и, соответственно, трагы огромной части молекулы мРНК.
Существует еще одно предположение, что на ДНК клетки синтезируются все возможные мРНК, которые поступают в цитоплазму, и процесс трансляции регулируется путем специфического и избирательного взаимодействия с определенными молекулами мРНК.
ИНГИБИТОРЫ СИНТЕЗА БЕЛКА
Одним из путей выяснения механизмов синтеза нуклеиновых кислот и белков в клетках является использование таких лекарственных препаратов, которые могли бы избирательно тормозить эти процессы у бактерий, не оказывая влияния на организм человека. Некоторые препараты действительно обладают таким действием, однако многие из них оказываются токсичными и для человека. В настоящее время в медицинской практике применяются многие антибиотики, часть из которых будет рассмотрена ниже с целью выяснения механизма их действия на ключевые химические реакции синтеза белка и нуклеиновых кислот.
Одним из мощных ингибиторов белкового синтеза является пуромицин. В результате структурного сходства с концевым остатком АМФ в аминоацил-тРНК' он легко взаимодействует с А-участком пептидил-тРНК с образованием пептидил-пуро-мицина.
Поскольку пептидил-пуромицин не несет на себе триплета антикодона, он тем самым тормозит элонгацию пептидной цепи, вызывая обрыв реакции. При помощи пуромицина было доказано, например, что гормональный эффект в ряде случаев зависит от синтеза белка de novo. Укажем также, что пуромицин тормозит синтез белка как у прокариот, так и у эукариот.
Белковый синтез тормозится актиномицином D, обладающим противоопухолевым эффектом, который вследствие высокой токсичности применяется редко. Он оказывает тормозящее влияние на синтез всех типов клеточной РНК, в особенности мРНК. Это свойство вызвано тормозящим влиянием актиномицина D на ДНК-зависимую РНК-полимеразу, поскольку он связывается с остатками дезоксигуанозина цепи ДНК, выключая матричную функцию последней. Можно считать, что актиномицин D ингибирует транскрипцию ДНК.
Другим антибиотиком, также тормозящим синтез клеточной РНК, является используемый при лечении туберкулеза рифамицин. Этот препарат тормозит ДНК-зависимую РНК-полимеразу путем связывания с ферментом. Наиболее чувствительна к нему бактериальная РНК-полимераза. На организм животных этот антибиотик оказывает незначительное влияние. По механизму действия он резко отличается от актиномицина D. Следует указать на недавно открытое противовирусное действие рифамицина, в частности, он успешно используется при лечении трахомы, которая вызывается ДНК-содержащим вирусом. По-видимому, этот антибиотик найдет применение в лечении опухолей, вызываемых вирусами.
Выяснены механизмы действия ряда других антибиотиков, применяемых при лечении тифозных инфекций. Так, хлорамфеникол оказывает ингибирующее влияние на пептидилтрансферазную реакцию (на стадии элонгации) синтеза белка в 70S рибосоме бактерий. На этот процесс в 80S рибосоме он не действует. Противоположное тормозящее действие на синтез белка в 80S (без поражения процесса в 70S рибосоме) оказывает циклогексимид, являющийся ингибитором транслоказы.
Весьма интересен молекулярный механизм действия дифтерийного токсина. Он оказался наделен способностью катализировать реакцию АДФ-рибозилирования фактора элонгации (трансляционный фактор-2, TF-2), выключая тем самым его из участия в синтезе белка. Резистентность многих животных к дифтерийному токсину обусловлена трудностью проникновения токсина через мембрану клеток.
Противотуберкулезные и антибактериальные антибиотики, в частности стрептомицин и неомицин, действуют на белоксинтезирующий аппарат чувствительных к ним штаммов бактерий. Высказано предположение, что эти антибиотики вызывают ошибки в трансляции мРНК, приводящие к нарушению соответствия между кодонами и включаемыми аминокислотами; например, кодон УУУ вместо фенилаланина начинает кодировать лейцин — в результате образуется аномальный белок, что приводит к гибели бактерий.
Широко применяемые в клинике тетрациклины также оказались ингибиторами синтеза белка в 70S рибосоме (меньше тормозится синтез в 80S рибосоме). Они легко проникают через клеточную мембрану. Считается, что тетрациклины тормозят связывание аминоацил-тРНК с аминоацильным центром в 50S субчастице рибосомы. Возможно, что тетрациклины химически связываются с этим центром, выключая тем самым одну из ведущих стадий процесса трансляции.
Пенициллины не являются истинными ингибиторами синтеза белка, однако их антибактериальный эффект связан с торможением синтеза гексапептидов, входящих в состав клеточной стенки. Механизм их синтеза отличается от рибосомального механизма синтеза белка. Эритромицин и олеандомицин тормозят активность транслоказы в процессе трансляции, подобно циклогексимиду, исключительно в 80S рибосомах, т. е. тормозят синтез белка в клетках животных.
Полученные к настоящему времени данные по механизму действия антибиотиков на синтез белка с учетом стадии и топографии процесса трансляции суммированы в табл. 13.2 (по Харперу).
Таблица 13.2. Антибиотики — ингибиторы трансляции
| Стадия трансляции | Эукариоты | Прокариоты | |
| цитоплазма | митохондрия | ||
| /. Инициация | |||
| Ауринтрикарбоновая кислота | — | — | + |
| //. Элонгация | |||
| Амицетин Анизомицин Линкомицин Неомицин Пуромицин Спарсомицин Тетради клины Фузидовая кислота Хлорамфеникол Циклогексимид | \ | + | |
| ///. Терминация | |||
| Амицетин Анизомицин Линкомицин Спарсомицин Стрептомицин Хлорамфеникол Эритромицин | 7 7 7 |
Н----торможение;-----отсутствие торможения; * —стимулирование;? — не известно.
Следует еще раз подчеркнуть, что нарушение или выпадение любого звена, участвующего в синтезе белка, почти всегда приводит к развитию патологии, причем клинические проявления болезни будут определяться природой и функцией белка, синтез которого оказывается нарушенным (структурный или функциональный белок). Иногда синтезируются так называемые аномальные белки как результат действия мутагенных факторов и, соответственно, изменения генетического кода (например, гемоглобин при серповидно-клеточной анемии). Последствия этих нарушений могут выражаться в развитии самых разнообразных синдромов или заканчиваться летально. Следует отметить, что организм располагает мощными механизмами защиты: подобные изменения генетического аппарата быстро распознаются специфическими ферментами — рестриктазами, измененные последовательности вырезаются и вновь замещаются соответствующими нуклеотидами при участии полиме-раз и лигаз.
Глава 14
ВЗАИМОСВЯЗЬ ОБМЕНА БЕЛКОВ, ЖИРОВ И УГЛЕВОДОВ
Живой организм и условия его существования находятся в постоянной зависимости от влияния окружающей среды. «Жизнь есть способ существования белковых тел, и этот способ существования состоит по своему существу в постоянном самообновлении химических составных частей этих тел» 1.
Обмен веществ в организме человека протекает не хаотично, а строго интегрирован и «тонко настроен». Все превращения органических веществ, процессы анаболизма и катаболизма тесно связаны друг с другом. В частности, процессы синтеза и распада взаимосвязаны, координированы и регулируются нейрогормональны-ми механизмами, придающими химическим процессам нужное направление. В организме человека, как и в живой природе вообще, не существует самостоятельного обмена белков, жиров, углеводов и нуклеиновых кислот. Все превращения объединены в единый процесс метаболизма, подчиняющийся диалектическим закономерностям взаимозависимости и взаимообусловленности.
Однако, помимо взаимных переходов между разными классами веществ в организме, доказано существование более сложных форм связи. В частности, интенсивность, направление любой химической реакции определяются ферментами, т. е. белками, которые оказывают прямое влияние на обмен липидов, углеводов и нуклеиновых кислот. В свою очередь синтез любого белка-фермента требует участия ДНК и всех трех типов рибонуклеиновых кислот — тРНК, мРНК и рРНК. Если к этому добавить влияние гормонов, а также продуктов распада какого-либо одного класса веществ (например, биогенных аминов) на обмен других классов органических веществ, то становится понятным удивительная согласованность и координированность огромного разнообразия химических процессов, совершающихся в организме. Многие из этих процессов были освещены при описании обмена отдельных классов веществ; в данной главе кратко будут представлены примеры взаимных переходов отдельных структурных элементов белков, жиров, углеводов и нуклеиновых кислот в процессе их превращений и обмена.
В настоящее время экспериментально обосновано существование трех главных этапов распада молекул углеводов, белков и жиров, которые интегрируют образование энергии из основных пищевых источников. На первом этапе полисахариды расщепляются до моносахаридов (обычно гексоз); жиры распадаются на глицерин и высшие жирные кислоты, а белки — на составляющие их свободные аминокислоты. Следует подчеркнуть, что указанные процессы в основном являются гидролитическими, поэтому освобождающаяся в небольшом количестве энергия почти целиком используется организмами в качестве тепла. На втором этапе мономерные молекулы (гек-созы, глицерин, жирные кислоты и аминокислоты) подвергаются дальнейшему распаду, в процессе которого образуются богатые энергией фосфатные соединения и ацетил-КоА. На третьем этапе, как ацетил-КоА, так и промежуточные метаболиты (ос-кето-глутарат, сукцинат и оксалоацетат), образующиеся из сотен органических веществ
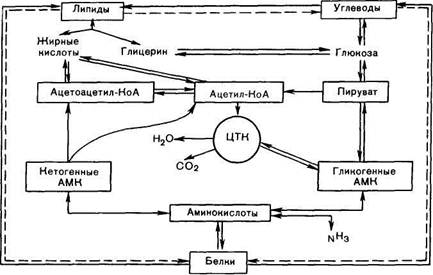
Рис. 14.1. Взаимодействие белков, жиров и углеводов.
пищи, подвергаются окислению («сгоранию») в цикле Кребса, давая энергию в виде АТФ; последний образуется в процессе окислительного фосфорилирования в митохондриях при переносе электронов от восстановленных пиридиновых и флавиновых нуклеотидов на молекулярный кислород.
Интенсивность обмена веществ регулируется как гормональными факторами, так и внутриклеточными регулирующими системами; более того, имеется немало доказательств, что живые организмы наделены удивительной способностью контролировать свой метаболизм. Однако необходимы дальнейшие усилия и знания, чтобы понять тонкости тех механизмов благодаря которым в целостном организме достигается постоянство сре;Лы.
Основные пути взаимопревращений белков, жиров и углеводов представлены на рис. 14.1. Помимо прямых переходов метаболитов этих классов веществ друг в друга, существует тесная энергетическая связь, когда энергетические потребности организма могут обеспечиваться окислением какого-либо одного класса органических веществ при недостаточном поступлении с пищей других. Важность белков (в частности, ферментов, гормонов и др.) в обмене всех типов химических соединений слишком очевидна и не требует доказательств. Выше также было указано на большую роль белков и аминокислот для синтеза ряда специализированных соединений (пуриновых и пиримидиновых нуклеотидов, порфиринов, биогенных аминов и др.). Кетогенные аминокислоты, образующие в процессе обмена ацетоуксусную кислоту (ацетоацетил-КоА), могут непосредственно участвовать в синтезе жирных кислот и стеринов. Аналогично могут использоваться гликогенные аминокислоты через аце-тил-КоА, но после предварительного превращения в пируват. Некоторые структурные компоненты специализированных липидов, в частности фосфоглицеридов, имеют своим источником аминокислоты и их производные, например серии, этаноламин, сфингозин и холин. Необходимо подчеркнуть, что путь превращения углеродных скелетов кетогенных или гликогенных аминокислот в жирные кислоты является необратимым процессом, хотя нельзя исключить возможности частичного синтеза глутамата и опосредованно других аминокислот из продуктов распада жирных кислот — ацетил-КоА - через цикл трикарбоновых кислот, включающий ос-кетоглутарат.
В то же время из глицерина нейтральных жиров через пируват полностью осуществляется синтез углеродных скелетов некоторых гликогенных аминокислот.
Продукты гидролиза пищевых и тканевых триглицеридов, в частности высшие ^ жирные кислоты, участвуют непосредственно в образовании сложных белков — липопротеинов плазмы крови. В составе липопротеинов, являющихся, таким образом, транспортной формой жирных кислот, они доставляются в органы-мишени, в которых жирные кислоты служат или источником энергии (сердечная и поперечнополосатая мускулатура), или предшественниками синтеза тканевых триглицеридов с последующим их отложением в органах (депо липидов).
Получены доказательства синтеза глюкозы из большинства аминокислот. В некоторых случаях (аланин, аспарагиновая и глутаминовая кислоты) эта связь является непосредственной, в других — осуществляется через побочные каналы. Следует особо подчеркнуть, что три а-кетокислоты (пируват, оксалоацетат и кетоглутарат), образующиеся соответственно из аланина, аспартата и глутамата, не только служат исходным материалом для синтеза глюкозы, но и являются своеобразными катализаторами в превращении ацетильных остатков всех классов пищевых веществ в цикле Кребса для получения энергии.
Синтез незаменимых аминокислот из продуктов обмена углеводов и жиров в организме не происходит. Клетки животных не содержат ферментных систем, катализирующих синтез углеродных скелетов этих аминокислот. Этим объясняется незаменимость белков в питании для человека и животных. В то же время организм может нормально развиваться исключительно при белковом питании, что также свидетельствует о возможности синтеза углеводов из белков. Процесс синтеза углеводов из аминокислот получил название глюконеогенеза, который доказан прямым путем в опытах на животных с экспериментальным диабетом, когда более 50% введенного белка превращается в глюкозу. Как известно, при диабете организм теряет способность утилизировать глюкозу и энергетические потребности покрываются за счет окисления аминокислот и жирных кислот. Доказано также, что исходными субстратами для глюконеогенеза являются те аминокислоты, распад которых сопровождается образованием прямо или опосредованно пировиноградной кислоты (например, аланин, серии, треонин и цистеин). Более того, имеются доказательства существования в организме своеобразного циклического процесса, названного глюкозо-аланиновым циклом, участвующего в тонкой регуляции концентрации глюкозы в крови в тех условиях, когда в период между приемами пищи организм испытывает дефицит глюкозы; источниками пирувата при этом являются указанные выше аминокислоты, образующиеся в мышцах при распаде белков и поступающие в печень, в которой они подвергаются дезаминированию; образовавшийся аммиак там же обезвреживается, участвуя в синтезе мочевины, которая выделяется из организма. Дефицит мышечных белков затем восполняется за счет поступления аминокислот пищи.
Энергетическая ценность пищи оказывает определенное влияние на белковый обмен, контролируемый азотистым балансом. Так, если потребляемая энергия пищи ниже минимального уровня, то наблюдается увеличение экскреции азота, и, наоборот, при увеличении энергетической ценности пищи экскреция азота с мочой снижается. Энергетическая ценность пищи, следовательно, является лимитирующим фактором в утилизации пищевых белков.
Из приведенной выше схемы видно также, что имеются различные пути взаимопревращений жиров и углеводов. Практика откорма сельскохозяйственных животных давно подтвердила возможность синтеза жиров из углеводов пищи. С энергетической точки зрения превращение углеводов в жиры следует рассматривать как накопление и депонирование энергии, хотя синтез жира сопровождается затратой энергии, которая вновь освобождается при окислении жиров в организме. Глицерин, входящий в состав триглицеридов и фосфоглицеридов, может легко образоваться из промежуточных метаболитов гликолиза, в частности из глицеральдегид-3-фосфата.
Следует, однако, подчеркнуть, что основным путем превращения углеводов в жиры является путь образования высших жирных кислот из ацетил-КоА, который образуется при окислительном декарбоксилировании пирувата. Последняя реакция практически необратима, поэтому образования углеводов из высших жирных кислот почти не происходит. Таким образом, синтез углеводов из жиров в принципе может происходить только из глицерина, хотя в обычных условиях реакция протекает в обратную сторону, т. е. в сторону синтеза жиров из глицерина, образующегося при окислении углеводов.
Ацетил-КоА, образующийся в процессе обмена углеводов, жиров и ряда аминокислот, служит пусковым субстратом как для синтеза жирных кислот (а следовательно, и липидов вообще), так и для цикла трикарбоновых кислот. Для окисления ацетил-КоА в этом цикле требуется оксалоацетат, который является вторым ключевым субстратом в цикле Кребса. Оксалоацетат может синтезироваться из пировино-градной кислоты и углекислого газа благодаря реакции карбоксилирования или образоваться из аспарагиновой кислоты в процессе трансаминирования. Две молекулы ацетил-КоА, конденсируясь, образуют ацетоуксусную кислоту (ацетоацетат), которая является источником других кетоновых тел в организме, в частности (3-оксимасляной кислоты (Р-оксибутирата) и ацетона (см. главу 10). Следует подчеркнуть, что ацетоуксусная и (З-оксимасляная кислоты часто рассматриваются как транспортные формы активной уксусной кислоты, доставляющие ее для окисления в цикле Кребса в периферические ткани. Эти же реакции конденсации двух молекул ацетил-КоА составляют начальные этапы синтеза холестерина, в свою очередь являющегося предшественником гормонов стероидной природы, витамина D3, а также желчных кислот; последние в виде парных желчных кислот выполняют важную функцию эмульгаторов при переваривании липидов пищи в кишечнике и способствуют всасыванию высших жирных кислот.
Следует указать также на использование галактозы и частично глюкозы для биосинтеза цереброзидов и гликолипидов, выполняющих специфические функции в деятельности ЦНС. В этих синтезах участвуют не свободные моносахариды, а галактозамин и глюкозамин, биосинтез которых в свою очередь требует доставки амидного азота глутамина, интегрируя, таким образом, обмен углеводов, липидов и белков.
Перечисленными примерами абсолютно не исчерпывается все многообразие взаимопревращений органических веществ, которое постоянно совершается в живых организмах. Здесь были приведены лишь главные, магистральные каналы и пути превращения общих классов веществ и указаны ключевые субстраты и ферментные системы, обеспечивающие постоянство химических компонентов и тканей и динамичность живых структур.
Таким образом, скорости распада одних питательных веществ и биосинтеза других прежде всего определяются физиологическим состоянием и потребностями организма в энергии и метаболитах. Этими факторами в значительной степени может быть объяснено существование постоянного динамического состояния химических составных компонентов организма как единого целого.
Благодаря этой динамичности и координации метаболической активности обеспечивается макро- и микроскопическое постоянство всех форм живого. Выяснение фундаментальных проблем структуры и функций отдельных биомолекул может служить основой для раскрытия как молекулярных механизмов химических процессов, лежащих в основе состава и функций отдельных клеток и целостного организма, так и процессов, обеспечивающих биологическую индивидуальность живых организмов. Любые нарушения этого динамического статуса организма сопровождаются развитием патологии, тяжесть и продолжительность которой будет определяться степенью повреждения структуры и функций клеток.
Глава 15 ПЕЧЕНЬ
Важнейшее значение печени в обмене веществ в первую очередь определяется тем, что она является как бы большой промежуточной станцией между портальным и общим кругом кровообращения. Более 70 % крови в печень человека поступает через воротную вену, остальная часть крови попадает в печень через печеночную артерию. Кровь воротной вены омывает всасывающую поверхность кишечника, и в результате большая часть веществ, всасывающихся в кишечнике, проходит через печень (кроме липидов, транспорт которых в основном осуществляется через лимфатическую систему).
Таким образом, печень функционирует как первичный регулятор содержания в крови веществ, поступающих в организм с пищей. Доказательством справедливости данного положения является следующий общеизвестный факт: несмотря на то что всасывание питательных веществ из кишечника в кровь происходит прерывисто, непостоянно, в связи с чем в портальном круге кровообращения могут наблюдаться изменения концентрации ряда веществ (глюкоза, аминокислоты и др.), в общем же круге кровообращения изменения в концентрации указанных соединений незначительны. Все это подтверждает важную роль печени в поддержании постоянства внутренней среды организма. Печень выполняет также крайне важную экскреторную функцию, теснейшим образом связанную с ее детоксикационной функцией. В целом же без преувеличения можно сказать, что в организме нет путей
> обмена веществ, которые прямо или косвенно не контролировались бы печенью, в связи с чем многие важнейшие функции печени уже обсуждены в соответствующих
— главах учебника. Поэтому в данной главе будет сделана попытка дать обобщающие представления о роли печени в обмене веществ целостного организма.
ХИМИЧЕСКИЙ СОСТАВ ПЕЧЕНИ
У взрослого здорового человека масса печени составляет в среднем 1,5 кг. Некоторые исследователи считают, что эту величину следует рассматривать как нижнюю границу нормальной при диапазоне колебаний в пределах 20 — 60 г на 1 кг массы тела.
В табл. 15.1 представлены некоторые данные о химическом составе печени в норме.
| Таблица 15.1. Химический состав печени | млекопитающих | ||
| Составные части | Содержание, % | Составные части | Содержание, % |
| Вода Сухой остаток Белок Липиды Триацилглицеролы | 70-75 25-30 12-24 2-6 1,5-2,0 | Фосфолипиды Холестерин Гликоген Железо | 1,5-3,0 0,3-0,5 2-8 0,02 |
Из таблицы видно, что более 70 % от массы печени составляет вода. Однако следует помнить, что масса печени и ее состав подвержены значительным колебаниям как в норме, так и особенно при патологических состояниях. Например, при отеках количество воды может составлять до 80% от массы печени, а при избыточном отложении жира количество воды в печени может снизиться до 55%. Более половины сухого остатка печени приходится на долю белков, причем примерно 90% из них — на долю глобулинов. Печень также богата различными ферментами. Около 5% от массы печени составляют липиды: нейтральные жиры (триглицериды), фосфолипиды, холестерин и др. При выраженном ожирении содержание липидов может достигать 20 % от массы органа, а при жировом перерождении печени количество липидов в этом органе может составлять 50% от сырой массы.
В печени может содержаться 150 — 200 г гликогена. Как правило, при тяжелых паренхиматозных поражениях печени количество гликогена в ней уменьшается. Напротив, при некоторых гликогенозах содержание гликогена может достигать 20% и более от массы печени.
Разнообразен и минеральный состав печени. Количество железа, меди, марганца, никеля и некоторых других элементов превышает их содержание в других органах и тканях. Ниже будет рассмотрена роль печени в разных видах обмена веществ.
РОЛЬ ПЕЧЕНИ В УГЛЕВОДНОМ ОБМЕНЕ
Основная роль печени в углеводном обмене заключается в обеспечении постоянства концентрации глюкозы в крови. Это достигается регуляцией соотношения между синтезом и распадом гликогена, депонируемого в печени.
Синтез гликогена в печени и его регуляция в основном аналогичны тем процессам, которые протекают в других органах и тканях, в частности в мышечной ткани. Синтез гликогена из глюкозы обеспечивает в норме временный резерв углеводов, необходимый для поддержания концентрации глюкозы в крови в тех случаях, когда ее содержание значительно уменьшается (например, у человека это происходит при недостаточном поступлении углеводов с пищей или в период ночного «голодания»).
Говоря об утилизации глюкозы печенью, необходимо подчеркнуть важную роль фермента глюкокиназы в этом процессе. Глюкокиназа, подобно гексокиназе, катализирует фосфорилирование глюкозы с образованием глюкозо-6-фосфата (см. главу 9). При этом активность глюкокиназы в печени почти в 10 раз превышает активность гексокиназы. Важное различие между этими двумя ферментами заключается в том, что глюкокиназа в противоположность гексокиназе имеет высокое значение Км для глюкозы и не ингибируется глюкозо-6-фосфатом.
После приема пищи содержание глюкозы в воротной вене резко возрастает; в тех же пределах увеличивается и ее внутрипеченочная концентрация '. Повышение концентрации глюкозы в печени вызывает существенное увеличение активности глюкокиназы и автоматически увеличивает поглощение глюкозы печенью (образовавшийся глюкозо-6-фосфат либо затрачивается на синтез гликогена, либо расщепляется).
Считают, что основная роль печени — расщепление глюкозы — сводится прежде всего к запасанию метаболитов-предшественников, необходимых для биосинтеза жирных кислот и глицерина, и в меньшей степени к окислению ее до СО2 и Н2О. Синтезированные в печени триглицериды в норме выделяются в кровь в составе липопротеинов и транспортируются в жировую ткань для более «постоянного» хранения.
В реакциях пентозофосфатного пути в печени образуется НАДФН2, используемый для восстановительных реакций в процессах синтеза жирных кислот, холестерина и других стероидов. Кроме того, при этом образуются пентозофосфаты, необходимые для синтеза нуклеиновых кислот.
Наряду с утилизацией глюкозы в печени, естественно, происходит и ее образование. Непосредственным источником глюкозы в печени служит гликоген. Распад гликогена в печени в основном происходит фосфоролитическим путем. В регуляции скорости гликогенолиза в печени большое значение имеет система циклических нуклеотидов. Кроме того, глюкоза в печени образуется также в процессе глюконеогенеза.
Основными субстратами глюконеогенеза служат лактат, глицерин и аминокислоты. Принято считать, что почти все аминокислоты, за исключением лейцина, могут пополнять пул предшественников глюконеогенеза.
При оценке углеводной функции печени необходимо иметь в виду, что соотношение между процессами утилизации и образования глюкозы регулируется прежде всего нейрогуморальным путем при участии желез внутренней секреции.
Центральную роль в превращениях углеводов и саморегуляции углеводного обмена в печени играет глюкозо-6-фосфат. Он резко тормозит фосфоролитическое расщепление гликогена, активирует ферментативный перенос глюкозы с уридинди-фосфоглюкозы на молекулу синтезирующегося гликогена, является субстратом для дальнейших гликолитических превращений, а также окисления глюкозы, в том числе по пентозофосфатному пути. Наконец, расщепление глюкозо-6-фосфата фосфатазой обеспечивает поступление в кровь свободной глюкозы, доставляемой током крови во все органы и ткани:
Рассматривая промежуточный обмен углеводов в печени, необходимо также остановиться на превращениях фруктозы и галактозы. Поступающая в печень фруктоза может фосфорилироваться в положении 6 до фруктозо-6-фосфата под действием гексокиназы, обладающей относительной специфичностью и катализирующей фосфо-рилирование, кроме глюкозы и фруктозы, еще и маннозы. Однако в печени существует и другой путь: фруктоза способна фосфорилироваться при участии и более специфического фермента — фруктокиназы. В результате образуется фруктозо-1-фосфат. Эта реакция не блокируется глюкозой. Далее фруктозо-1-фосфат под действием альдолазы расщепляется на две триозы: диоксиацетонфосфат и глицеральдегид. Под влиянием соответствующей киназы (триокиназы) и при участии АТФ глицеральдегид подвергается фосфорилированию до глицеральдегид-3-фосфата. Образовавшийся глицеральдегид-3-фосфат (в последний легко переходит и диоксиацетонфосфат) подвергается обычным превращениям, в том числе с образованием в качестве промежуточного продукта пировиноградной кислоты.
Галактоза в печени сначала фосфорилируется при участии АТФ и фермента галактокиназы с образованием галактозо-1-фосфата. Галактокиназа печени плода И ребенка характеризуется Кы и Vmax, примерно в 5 раз превосходящими таковьв у ферментов взрослого человека. Большая часть галактозо-1-фосфата в печени превращается в ходе реакции, катализируемой гексозо-1 -фосфат-уридилилтранс* феразой:
УДФ-глюкоза + галактозо-1-фосфат -> УДФ-галактоза + глюкозо-1-фосфат
Эта уникальная трансферазная реакция возвращения галактозы в основное русло углеводного метаболизма. Наследственная утрата гексозо-1-фосфат-уридилилтранс-' феразы приводит к галактоземии — заболеванию, для которого характерны умственная отсталость и катаракта хрусталика. В этом случае печень новорожденных теряет способность метаболизировать D-галактозу, входящую в состав лактозы молока.
РОЛЬ ПЕЧЕНИ В ЛИПИДНОМ ОБМЕНЕ
Ферментативные системы печени способны катализировать все или подавляющее большинство реакций метаболизма липидов. Совокупность этих реакций лежит в основе таких процессов, как синтез высших жирных кислот, триглицеридов, фосфо-липидов, холестерина и его эфиров, а также липолиз триглицеридов, окисление жирных кислот, образование ацетоновых (кетоновых) тел и т. д.
Напомним, что ферментативные реакции синтеза триглицеридов в печени и жировой ткани сходны. А именно, КоА-производные жирной кислоты с длинной цепью взаимодействуют с глицерол-3-фосфатом с образованием фосфатидной кислоты, которая затем гидролизуется до диглицерида. Путем присоединения к последнему еще одной молекулы КоА-производного жирной кислоты образуется триглицерид. Синтезированные в печени триглицериды либо остаются в печени, либо секретируются в кровь в форме липопротеинов. Секреция происходит с известной задержкой (у человека 1 — 3 ч). Задержка секреции, вероятно, соответствует времени, необходимому для образования липопротеинов.
Как уже отмечалось, основным местом образования плазменных пре-|3-липопро-теинов (липопротеинов очень низкой плотности — ЛПОНП) и а-липопротеинов (липопротеинов высокой плотности — ЛПВП) является печень. К сожалению, пока нет точных данных о последовательности сборки липопротеиновых частиц в гепатоцитах, не говоря уже о механизмах этого процесса.
У человека основная масса (3-липопротеинов (липопротеинов низкой плотности — ЛПНП) образуется в плазме крови из ЛПОНП при действии липопротеинлипазы. В ходе этого процесса образуются сначала промежуточные короткоживущие липо-протеины (Пр.ЛП). Через стадию образования промежуточных липопротеинов формируются частицы, обедненные триглицеридами и обогащенные холестерином, т. е. образуются ЛПНП (рис. 15.1).
При высоком содержании жирных кислот в плазме их поглощение печенью возрастает, усиливается синтез триглицеридов, а также окисление жирных кислот, что может привести к повышенному образованию кетоновых тел.
Следует подчеркнуть, что кетоновые тела образуются в печени в ходе так называемого Р-окси-Р-метилглутарил-КоА пути. Как уже отмечалось» прежние представления о том, что кетоновые тела являются промежуточными продуктами окисления жирных кислот в печени, оказались ошибочными. Из печени кетоновые тела током крови доставляются в ткани и органы (мышцы, почки, мозг и др.), где они быстро окисляются при участии соответствующих ферментов. В самой же ткани печени кетоновые тела не окисляются, т. е. в этом плане по сравнению с другими тканями печень является исключением.
В печени происходит как интенсивный распад фосфолипидов, так и их синтез. Помимо глицерина и жирных кислот, которые входят в состав нейтральных жиров, для синтеза фосфолипидов необходимы неорганические фосфаты и азотистые основания, в частности холин для синтеза фос-фатидилхолина. Неорганические фосфаты в печени имеются в достаточном количестве. Другое дело — холин. При недостаточном образовании или недостаточном поступлении его в печень синтез фосфолипидов из компонентов нейтрального жира становится либо невозможным, либо резко снижается, и нейтральный жир откладывается в печени. В этом случае говорят о жировой инфильтрации печени, которая может затем перейти в ее жировую дистрофию. Иными словами, синтез фосфолипидов лимитируется количеством/ азотистых
оснований, т. е. для синтеза фосфоглицеридов необходимы либо холин, либо соединения, которые могут являться донорами метальных групп и участвовать в образовании холина (например, метионин). Последние соединения получили название липотропных веществ. Отсюда становится ясным, почему при жировой инфильтрации печени весьма полезен творог, содержащий белок казеин, в составе которого имеется большое количество остатков аминокислоты метионина.
Рассмотрим роль печени в обмене стероидов, в частности холестерина. Часть холестерина поступает в организм с пищей, но значительно большее количество его синтезируется в печени из ацетил-КоА. Биосинтез холестерина в печени подавляется экзогенным холестерином, т. е. получаемым с пищей.
Таким образом, биосинтез холестерина в печени регулируется по принципу отрицательной обратной связи. Чем больше холестерина поступает с пищей, тем меньше его синтезируется в печени, и наоборот. Принято считать, что действие экзогенного холестерина на биосинтез его в печени связано с торможением (3-окси-Р-метилглутарил-КоА-редуктазной реакции:
Часть синтезированного в печени холестерина выделяется из организма совместно с желчью, другая часть превращается в желчные кислоты и используется в других органах для синтеза стероидных гормонов и других соединений.
В печени холестерин может взаимодействовать с жирными кислотами (в виде ацил-КоА) с образованием эфиров холестерина. Синтезированные в печени эфиры холестерина поступают в кровь, в которой содержится также определенное количество свободного холестерина.
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 1559; Нарушение авторских прав?; Мы поможем в написании вашей работы!