
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
БИОХИМИЯ 1 страница
|
|
|
|
С. С. Михайлов
Спортивная
!____________________________ Ju__________________ ^

|
УДК 577.1 ББК 28.072 М69
Рецензенты:
Розенгарт Е.В. — доктор биологических наук, профессор Санкт- Петербургской государственной академии физической культуры им. П. Ф. Лесгафта; Волков Н.И. — доктор биологических наук, профессор Российского государственного университета физической культуры, спорта и туризма
Михайлов С.С.
М69 Спортивная биохимия: Учебник для вузов и колледжей физической культуры. - 2-е изд., доп. - М.: Советский спорт, 2004. - 220 е.: ил.
ISBN 5-85009-876-3
Учебник написан в соответствии с Государственным образовательным стандартом по биохимии для вузов физической культуры. В первой части учебника описаны строение и свойства главных классов органических соединений организма, рассмотрены основные метаболические процессы, дана биохимическая характеристика крови и мочи. Во второй части учебника всесторонне освещены биохимические аспекты мышечной деятельности, рассмотрены молекулярные основы двигательных качеств спортсмена, адаптации организма к физическим нагрузкам и затронута проблема питания спортсменов.
Предназначен для студентов дневной и заочной форм обучения высших и средних специальных учебных заведений физической культуры.
УДК 577.1 ББК 28.072
ISBN 5-85009-876-3 © Михайлов С.С., 2002
© Михайлов С.С., 2004 © Оформление. ФГУП «Издательство "Советский спорт"», 2004
ВВЕДЕНИЕ
Биохимия изучает в самом общем виде химическую сторону жизни.
Обычно выделяют три главные задачи, стоящие перед этой научной дисциплиной:
1. Изучение химического состава живого организма, строения и свойств молекул, из которых он состоит.
2. Изучение обмена веществ, т. е. химических превращений, которым подвергаются входящие в организм молекулы (раздел биохимии, решающий эти задачи, называется «Общая биохимия»).
3. Изучение особенностей химического состава и обмена веществ отдельных представителей живого мира (например, у микробов, растений, животных), изучение химического состава и обмена веществ при различных заболеваниях и при поступлении в организм экзогенных веществ (ядов, лекарственных средств). К этой задаче также относится изучение влияния на организм разнообразных физических нагрузок, в том числе применяемых в спорте.
В целом раздел биохимии, занимающийся решением третьей задачи, называется «Функциональная, или частная, биохимия».
Направлением функциональной биохимии, исследующим влияние физических упражнений на организм спортсмена, является «Спортивная биохимия».
Биохимия как учебная дисциплина играет важную роль в подготовке специалистов в области физической культуры. Это положение можно обосновать следующим:
• Специалист в области физической культуры обязан в полной мере знать устройство объекта своей профессиональной деятельности, т. е. человека, должен иметь представление о химическом строении организма и о химических процессах, лежащих в основе жизнедеятельности.
• Тренер и преподаватель физического воспитания должны знать особенности обмена веществ во время физической работы и отдыха, использовать эти закономерности для рационального построения тренировочного процесса, для установления оптимальных сроков восстановления.
• Используя простейшие биохимические исследования, тренер и преподаватель физвоспитания должны уметь оценить соответствие фи-
Часть 1
ОБЩАЯ БИОХИМИЯ [1]
ГЛАВА 1 ОБЩАЯ ХАРАКТЕРИСТИКА ХИМИЧЕСКОГО СОСТАВА ОРГАНИЗМА"
Организм человека имеет следующий химический состав: вода - 60-65%, органические соединения - 30-32%, минеральные вещества - 4%.
Наибольшее значение для живых организмов имеют органические соединения. Важнейшими классами органических соединений, входящих в живые организмы, являются белки, нуклеиновые кислоты, углеводы и липиды.
БЕЛКИ
Белки выполняют в организме очень важные функции. К ним в первую очередь следует отнести: структурную, каталитическую, сократительную, транспортную, регуляторную, защитную, а также энергетическую. На долю белков в среднем приходится 1/6 часть от массы тела человека.
По строению белки - это высокомолекулярные азотсодержащие соединения, состоящие из аминокислот. В состав белковых молекул могут входить десятки, сотни и тысячи остатков аминокислот. Однако все белки, независимо от происхождения, содержат лишь 20 видов амино
кислот Строение 20 разновидностей аминокислот, входящих во все бедаи, можно отразить следующей формулой:
r
........ i
H-C-nh2
У всех аминокислот можно выделить общую, одинаковую часть молекулы, содержащую амино- и карбоксильную группы (выделена пунктирной рамкой). Другая же часть молекулы, обозначенная как радикал (R), у каждой из 20 аминокислот имеет специфическое строение, и аминокислоты отличаются друг от друга только радикалами. (Классификация, формулы и некоторые свойства аминокислот приведены в приложении 1.)
Аминокислоты, соединяясь друг с другом пептидной связью, образуют длинные неразветвленные цепи - полипептиды. Пептидная связь возникает при взаимодействии карбоксильной группы одной аминокислоты и аминогруппы другой аминокислоты с выделением воды:
| H, CH-COOH |
r1 r2 nh2-ch-cooh +nh2-ch-cooh __ _
-н2о
| ■о | н: | |
| nh2 -сн | —;с | —n —i |
| Пешидная связь |
Пептидные связи обладают высокой прочностью, их образуют все аминокислоты.
В состав белковой молекулы входит один или несколько полипептидов.
Кроме пептидных, в белках обнаруживаются еще дисульфидные, водородные, ионные и другие связи.
Эти химические связи могут возникать между остатками аминокислот, которые входят в разные участки одного и того же полипептида или же находятся в разных полипептидах, но обязательно пространственно сближены. В первом случае благодаря таким связям полипептидная цепь принимает определенную пространственную форму. Во втором случае с помощью непептидных связей полипептиды объединяются в белковую молекулу.
В итоге молекула белка является объемным, трехмерным образованием, имеющим определенную пространственную форму. Для удобства рассмотрения пространственного строения молекулы белка условно выделяют четыре уровня ее структурной организации.
Первый уровень пространственной организации белковой молекулы называется первичной структурой и представляет собой последовательность расположения аминокислот в полипептидных цепях. Фиксируется эта структура прочными пептидными связями. Другими словами, первичная структура характеризует химическое строение полипептидов, образующих белковую молекулу. Каждый индивидуальный белок имеет уникальную первичную структуру.
Второй уровень пространственной организации - вторичная структура - описывает пространственную форму полипептидных цепей. Например, у многих белков полипептидные цепи имеют форму спирали. Фиксируется вторичная структура дисульфидными и различными нековалентными связями.
Третий уровень пространственной организации - третичная структура - отражает пространственную форму вторичной структуры. Например, вторичная структура в форме спирали, в свою очередь, может укладываться в пространстве в виде глобулы, т. е. имеет шаровидную или яйцевидную форму. Стабилизируется третичная структура слабыми нековалентными связами, а также дисульфидными связями и поэтому является самой неустойчивой структурой.
Пространственная форма всей белковой молекулы получила название конформация. Поскольку в молекуле белка наряду с прочными ковалентными связями имеются еще менее прочные (нековалентные) связи, то его конформация характеризуется нестабильностью и может легко изменяться. Изменение пространственной формы белка влияет на его биологические функции. Конформация, находясь в которой белок обладает биологической активностью, называется нативной. Любые воздействия на белок, приводящие к нарушению этой конформа- ции, сопровождаются частичной или полной утратой белком его биологических свойств. Изменение конформации в небольших пределах обратимо и является одним из механизмов регуляции биологических функций белков в организме.
Четвертичной структурой обладают только некоторые белки. Четвертичная структура - это сложное надмолекулярное образование, состоящее из нескольких белков, имеющих свою собственную первичную, вторичную и третичную структуры. Каждый белок, входящий в состав четвертичной структуры, называется субъединицей. Например, белок крови гемоглобин состоит из четырех субъединиц двух типов (а и Р) и имеет строение а2рг- Ассоциация субъединиц в четвертичную структуру приводит к возникновению нового биологического свойства, отсутствующего у свободных субъединиц. Например, формирование четвертичной структуры в ряде случаев сопровождается появлением каталитической активности, которой нет у отдельных субъединиц.
Объединяются субъединицы в четвертичную структуру за счет слабых нековалентных связей, и поэтому четверичная структура неустойчива и легко диссоциирует на субъединицы. Образование и диссоциация четвертичной структуры является еще одним механизмом регуляции биологических функций белков.
Из всех структур белка кодируется только первичная. За счет информации, заключенной в молекуле ДНК, синтезируются полипептидные цепи (первичная структура). Высшие структуры (вторичная, третичная, четвертичная) возникают самопроизвольно в соответствии со строением полипептидов.
Классификация белков
Белки делятся на простые (протеины) и сложные (протеиды). Простые белки состоят только из аминокислот. К простым белкам, имеющимся в организме человека, относятся альбумины, глобулины, гистоны, белки опорных тканей. В молекуле сложного белка, кроме аминокислот, еще имеется неаминокислотная часть, называемая простетической группой. В зависимости от строения про- стетической группы выделяют такие сложные белки, как фосфопро- теиды (содержат в качестве простетической группы фосфорную кислоту), нуклеопротеиды (содержат нуклеиновую кислоту), глико- протеиды (содержат углевод), липопротеиды (содержат липоид), хромопротеиды (содержат окрашенную простетическую группу) и др.
Возможна и другая классификация белков, вытекающая из их пространственной формы. В этом случае белки разделяются на два больших класса: глобулярные и фибриллярные.
Молекулы глобулярных белков имеют шарообразную или эллипсоидную форму. Примером таких белков являются альбумины и глобулины плазмы крови.
Фибриллярные белки представляют собою вытянутые молекулы, у которых длина значительно превышает их диаметр. К таким белкам прежде всего необходимо отнести коллаген - самый распространенный белок у человека и высших животных, на долю которого приходится 25-30% от общего количества белков организма. Коллаген обладает высокой прочностью и эластичностью. Этот белок широко распространен в организме, он входит в состав соединительной ткани, и поэтому его можно обнаружить в коже, стенках сосудов, мышцах, сухожилиях, хрящах, костях, во внутренних органах.
НУКЛЕИНОВЫЕ КИСЛОТЫ
По своему строению нуклеиновые кислоты являются полинуклео- тидами, состоящими из очень большого количества мононуклеотидов (нуклеотидов). Любой нуклеотид обязательно включает в себя азотистое основание (циклическое соединение, содержащее атомы азота и обладающее щелочными свойствами), углевод и фосфорную кислоту.
Азотистые основания бывают двух типов: пуриновые и пирими- диновые.
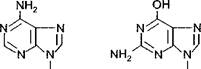 Н Н
Аденин Гуанин
Н Н
Аденин Гуанин
|
| Пиримидиновыми основаниями являются урацил, тимин и цитозин: |
 Урацил Тимин Цитозин
Урацил Тимин Цитозин
|
К пуриновым основаниям относятся аденин и гуанин, имеющие следующее строение:
Углеводом, входящим в состав нуклеотидов, может быть рибоза или дезоксирибоза, находящиеся в циклической форме:
он/о. сн2он он/о. сн2он
он он н он
Рибоза Дезоксирибоза
Азотистые основания присоединяются к первому углеродному атому (С]) углевода. Азотистое основание, связанное с углеводом, называется нуклеозидом.
Нуклеозиды, содержащие аденин и гуанин, называются соответственно аденозин и гуанозин, а нуклеозиды с пиримидиновыми основаниями получили названия: уридин, тимидин и цитидин.
Если в состав нуклеозида входит дезоксирибоза, то в название нук- леозида входит еще приставка «дезокси-». Например, нуклеозид, со
стоящий из аденина и рибозы, называется «аденозин», а нуклеозид, содержащий аденин и дезоксирибозу, носит название «дезоксиаденозин», или в сокращенном виде «д-аденозин».
Фосфорная кислота присоединяется эфирной связью к пятому атому углерода рибозы или дезоксирибозы. Поэтому нуклеотиды можно рассматривать как нуклеозидфосфаты.
Нуклеотиды, входящие в состав нуклеиновых кислот, имеют один остаток фосфорной кислоты, а свободные нуклеотиды могут содержать от одного до трех фосфатных остатков.
Название нуклеотидов состоит из трех частей: название нуклеозида, входящего в данный нуклеотид; числительное, показывающее количество остатков фосфорной кислоты, и слово «фосфат»:
| аденозин - гуанозин ■ •уридин - тимидин - цитидин - |
| моно- ди - три - |
| фосфат |
| (дезокси); |
Например, нуклеотид, состоящий из аденина, рибозы и фосфорной кислоты, называется аденозинмонофосфат, или сокращенно АМФ, и имеет следующее строение:
----- N ОН
СН20—Р=0
Аденин
\Н W он
он он
Рибоэа
Нуклеотиды, входящие в нуклеиновые кислоты, соединяются друг с другом в длинные полинуклеотидные цепи эфирными связями, идущими от углевода одного нуклеотида к фосфорной кислоте соседнего:
Аз. основание—углевод—фосфат Аз. основание —углевод —фосфат Аз. основание —углевод —фосфат Аз. основание —углевод —фосфат
В результате такого связывания образуется длинная цепь, состоящая из чередующихся остатков углевода и фосфорной кислоты. Азотистые основания непосредственно в эту цепь не входят; они как боковые веточки присоединяются к углеводам. Отличаются полинуклеотиды друг от друга длиной (т. е. количеством нуклеотидов) и последовательностью расположения азотистых оснований.
| Особенности строении и свойства РНК н ДНК |
Оказалось, что в одну молекулу нуклеиновых кислот может входить углевод только одного вида - рибоза или дезоксирибоза. На этом основании все нуклеиновые кислоты делятся на два типа: рибонуклеиновые - РНК (содержат рибозу) и дезоксирибонуклеиновые - ДНК (содержат дезоксирибозу). Особенности строения и биологические функции РЖ и ДНК отражены в табл. 1.
Таблица 1
|
*
1 Да (дальтон, атомная, или углеродная, единица) = 1,66-КГ24 г.
Как видно из таблицы, ДНК имеет более сложное строение. Состоит молекула ДНК из двух полинуклеотидных цепей, закрученных в спираль вокруг общей оси и образующих двойную спираль (рис. 1).
Один виток каждой спирали содержит 10 нуклеотидов, диаметр двойной спирали около 2 нм. Азотистые основания обеих цепей находятся внутри двойной спирали и соединены друг с другом водородными связями. Связывание (спаривание) азотистых оснований осуществляется строго определенным образом. Аденин всегда соединяется с тимином, а гуанин - с ци- тозином, причем все без исключения основания одной цепи спарены с основаниями второй. Вследствие этого обе нук- леотидные цепи, образующие молекулу ДНК, имеют одинаковую длину и пространственно соответствуют друг другу. Если в каком-то месте одной цепи находится аденин, то обязательно напротив него в другой цепи присутствует тимин, а напротив гуанина всегда располагается цитозин.
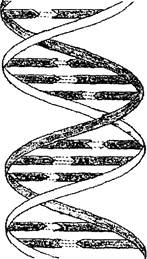 Рис. 1. Схема строения ДНК
Рис. 1. Схема строения ДНК
|
Такое пространственное соответствие двух полинуклеотидных цепей ДНК получило название комплементарность.
Принцип комплементарности лежит в основе таких важнейших процессов, как репликация (удвоение молекулы ДНК в процессе клеточного деления), транскрипция (передача генетической информации с молекулы ДНК информационной РНК в процессе синтеза белков) и трансляция (сборка из аминокислот белковой молекулы на рибосомах).
УГЛЕВОДЫ
Углеводы - это альдегидоспирты или кетоспирты и их производные. В природе углеводы содержатся главным образом в растениях. В организме человека углеводов около 1%.
Основным природным углеводом является глюкоза, которая может находиться как в свободном виде (моносахарид), так и в составе олиго-
сахаридов (сахароза, лактоза и др.) и полисахаридов (клетчатка, крахмал, гликоген).
Эмпирическая формула глюкозы СбН1206. Однако, как известно, глюкоза может иметь различные пространственные формы (ациклическую и циклические). В организме человека почти вся глюкоза (свободная и входящая в олиго- и полисахариды) находится в циклической а-пиранозной форме:

|
Свободная глюкоза в организме человека в основном находится в крови, где ее содержание довольно постоянно и колеблется в узком диапазоне от 3,9 до 6,1 ммоль/л (70-110 мг%).
Другим углеводом, типичным для человека и высших животных, является гликоген. Состоит гликоген из сильно разветвленных молекул большого размера, содержащих десятки тысяч остатков глюкозы. Эмпирическая формула гликогена - (С6Н10О5)п (С6Н10О5 - остаток глюкозы).
Гликоген является запасной, резервной формой глюкозы. Основные запасы гликогена сосредоточены в печени (до 5-6% от массы печени) и в мышцах (до 2-3% от их массы).
Глюкоза и гликоген в организме выполняют энергетическую функцию, являясь главными источниками энергии для всех клеток организма.
ЛИПИДЫ
Молекула жира состоит из остатка спирта - глицерина и трех остатков жирных кислот, соединенных сложноэфирной связью
О
II
сн2 — о — с — r,
I О
1 II
сн — о — с — r2
I О
1 II
СН2 — о — С — R3
Жирные кислоты, входящие в состав жиров, делятся на предельные, или насыщенные, (не имеют двойных связей) и непредельные, или ненасыщенные, (содержат одну или несколько двойных связей). Наиболее часто в состав природных жиров входят жирные кислоты, содержащие 16 или 18 атомов углерода (насыщенные: пальмитиновая, стеариновая; ненасыщенные: олеиновая, линолевая).
Отличаются друг от друга жиры разного происхождения набором жирных кислот.
Подобно углеводам жиры также являются важными источниками энергии для организма. 1 г жира при полном окислении дает около 9 ккал энергии, в то время как при полном окислении 1 г углеводов или белков выделяется только около 4 ккал. Однако жиры по сравнению с углеводами труднее окисляются и поэтому используются организмом для получения энергии во вторую очередь.
Липоиды являются обязательными компонентами всех биологических мембран. В организме человека имеются три класса липоидов: фосфолипиды, гликолипиды и стероиды.
ГЛАВА 2 ОБЩАЯ ХАРАКТЕРИСТИКА ОБМЕНА ВЕЩЕСТВ
Обязательным условием жизни является обмен веществ между живым организмом и окружающей средой. Из внешней среды в организм поступают источники энергии, строительный материал для различных синтезов, витамины, минеральные вещества, вода и кислород. Из организма вовне удаляются конечные продукты химических процессов, протекающих в организме: углекислый газ, вода и аммиак (в форме мочевины).
Обменные процессы, протекающие в организме, можно условно разделить на два этапа: пищеварение и метаболизм.
В процессе пищеварения пищевые вещества, как правило, высокомолекулярные и для организма чужеродные, под действием пищеварительных ферментов расщепляются и превращаются в конечном счете в простые соединения - универсальные для всех живых организмов. Так, например, любые пищевые белки распадаются на аминокислоты 20 видов, точно такие же, как и аминокислоты самого организма. Из углеводов пищи образуется универсальный моносахарид - глюкоза. Поэтому конечные продукты пищеварения могут вводиться во внутреннюю среду организма и использоваться клетками для разнообразных целей.
Метаболизм - это совокупность химических реакций, протекающих во внутренней среде организма, т. е. в его клетках. В настоящее время известны десятки тысяч химических реакций, составляющих метаболизм.
В свою очередь, метаболизм делится на катаболизм и анаболизм.
Под катаболизмом понимаются химические реакции, за счет которых крупные молекулы подвергаются расщеплению и превращаются в молекулы меньшего размера. Конечными продуктами катаболизма являются такие простейшие вещества, как С02, Н20 и NH3.
Для катаболизма характерны следующие закономерности:
• В процессе катаболизма преобладают реакции окисления.
• Катаболизм протекает с потреблением кислорода.
• В процессе катаболизма освобождается энергия, примерно половина которой аккумулируется в форме химической энергии аденозин- трифосфата (АТФ). Другая часть энергии выделяется в виде тепла.
Анаболизм включает разнообразные реакции синтеза.
Анаболизм характеризуется следующими особенностями:
• Для анаболизма типичны реакции восстановления.
• В процессе анаболизма происходит потребление водорода. Обычно используются атомы водорода, отщепляемые от глюкозы и переносимые коферментом НАДФ (в форме НАДФН2) (см. главу 5 «Обмен углеводов»).
• Анаболизм протекает с потреблением энергии, источником которой является АТФ.
ОСНОВНОЕ НАЗНАЧЕНИЕ МЕТАБОЛИЗМА
• В случае преобладания анаболизма над катаболизмом происходит накопление химических веществ в организме, в первую очередь белков. Накопление белков в организме - обязательное условие его роста и развития.
• Обеспечение энергией (в форме молекул АТФ) всех потребностей организма.
СТРОЕНИЕ И БИОЛОГИЧЕСКАЯ РОЛЬ АТФ___________________________
Аденозинтрифосфат (АТФ) является нуклеотидом. В состав молекулы АТФ входят азотистое основание - аденин, углевод - рибоза и три остатка фосфорной кислоты (аденин, связанный с рибозой, называется аденозином).
Особенностью молекулы АТФ является то, что второй и третий остатки фосфорной кислоты присоединяются связью, богатой энергией. Такая связь называется высокоэнергетической, или макроэргичес- кой, и обозначается знаком Соединения, имеющие макроэргические связи, обозначаются термином «макроэрги».
Структурная формула АТФ имеет следующий вид:
NH,

|
ОН ОН
Рибоза
В упрощенном виде строение АТФ можно отразить схемой: Аденин — рибоза.— Ф.К. ~ Ф.К. ~ Ф.К.
Y
аденозин
При использовании АТФ в качестве источника энергии обычно происходит отщепление путем гидролиза последнего остатка фосфорной кислоты:
АТФ + Н20 -> АДФ + Н3Р04 + Q (энергия)
В физиологических условиях, т. е. при тех условиях, которые имеются в живой клетке (температура, рН, осмотическое давление, концентрация реагирующих веществ и пр.), расщепление моля АТФ (506 г) сопровождается выделением 12 ккал, или 50 кДж* энергии.
Главными потребителями энергии АТФ в организме являются:
• реакции синтеза;
• мышечная деятельность;
• транспорт молекул и ионов через мембраны (например., всасывание веществ из кишечника, образование мочи в почках, формирование и передача нервного импульса и др.).
Таким образом, биологическая роль АТФ заключается в том, что это вещество является универсальным аккумулятором энергии, своего рода энергетической «валютой» клетки.
Основным поставщиком АТФ является тканевое дыхание - завершающий этап катаболизма, протекающий в митохондриях всех клеток, кроме красных клеток крови (эритроцитов).
Полезная информация
В сутки взрослый человек, не выполняющий физической работы, вдыхает и выдыхает 8-10 м3 воздуха, из которого в легких извлекается и используется организмом в обмене веществ 400-500 л кислорода.
В этих же условиях в сутки в процессе обмена веществ образуется и выделяется из организма 350-450 л углекислого газа.
Выполнение физических нагрузок приводит к значительному увеличению потребления кислорода и выделению углекислого газа.
ГЛАВА 3 ФЕРМЕНТАТИВНЫЙ КАТАЛИЗ
Ферменты, или энзимы, - это особые белки, выполняющие роль катализаторов химических реакций. Практически все химические реакции в организме протекают с огромными скоростями благодаря участию ферментов.
СТРОЕНИЕ ФЕРМЕНТОВ____________________________________________
Участок молекулы фермента, на котором происходит катализ, получил название «активный центр». Если фермент по строению является Простым белком, то его активный центр формируется только остатками
1 ккал = 4,18 кДж.
аминокислот, которые обычно находятся в разных участках одной и той же полипептидной цепи или же в разных полипептидах, но пространственно сближены. Другими словами активный центр образуется на уровне третичной структуры белка-фермента. У ферментов - сложных белков в состав активного центра часто входит их простетическая группа.
Образование активного центра из функциональных групп, довольно далеко отстоящих друг от друга в полипептидных цепях, но совмещенных пространственно в активном центре (т. е. на уровне третичной структуры белка), позволяет ферменту за счет конформационных изменений обеспечивать необходимое соответствие между активным центром и молекулами реагирующих веществ (их обычно называют субстратами). Благодаря изменению конформации фермента происходит как бы «приспособление», «подгонка» активного центра к структуре молекул, превращение которых ускоряется данным ферментом.
Изменение конформации молекулы фермента является также одним из механизмов регуляции скорости ферментативных реакций (см. ниже).
В активном центре обычно выделяют два участка - адсорбционный и каталитический.
Адсорбционный участок (центр связывания) по своему строению соответствует структуре реагирующих соединений, и поэтому к нему легко присоединяются молекулы субстрата.
Каталитический участок активного центра непосредственно осуществляет ферментативную реакцию.
Большинство ферментов содержат в своей молекуле только один активный центр. У некоторых ферментов может иметься несколько активных центров.
МЕХАНИЗМ ДЕЙСТВИЯ ФЕРМЕНТОВ
В любом катализе, осуществляемом ферментами, можно обнаружить три обязательные стадии.
|
|
|
|
|
Дата добавления: 2015-05-06; Просмотров: 681; Нарушение авторских прав?; Мы поможем в написании вашей работы!